코오롱생명과학 "미국 3상까지 갔는데…신약 국내출시 못해" 날벼락
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
'규제의 덫'에 빠진 코오롱생명과학
바이오치료제 210억弗 시장
일본, 질병종류 제한 삭제…한국은 되레 규제로 '발목'
임상시험, 중국 43건·한국 17건
바이오치료제 210억弗 시장
일본, 질병종류 제한 삭제…한국은 되레 규제로 '발목'
임상시험, 중국 43건·한국 17건
하지만 2012년 법 개정 이후 상황이 달라졌다. 당시 정부와 코오롱생명과학도 생명윤리법 개정안이 이 같은 문제를 야기할지는 미처 예상하지 못했다. 지난 5월 미국 식품의약국(FDA)의 임상 3상(의약품 허가 마지막 단계) 승인 결정 이후 8만원대이던 주가가 21만원까지 급등하는 등 관심을 모으고 있는 코오롱생명과학의 신약개발이 국내에서 뜻하지 않은 ‘규제 암초’를 만난 것이다.
◆거꾸로 가는 신약개발 규제
2012년 당시 정부는 유전자 치료제에 대한 안전성 문제가 부각되자 유전자 치료제 허가 기준을 강화했다. 연구 질환 대상을 ‘유전질환, 암, 후천성면역결핍증 그 밖에 생명을 위협하거나 심각한 장애를 일으키는 질병’으로 제한했다. 그러면서 ‘현재 이용 가능한 치료법이 없거나 유전자 치료의 효과가 다른 치료와 비교했을 때 현저히 우수할 것으로 예측되는 경우’란 조건도 함께 충족해야 신약허가를 내주도록 했다. 퇴행성관절염 치료제는 생명과 직접 관련된 질병으로 보기 어렵다는 게 업계의 중론이다. 두 가지 조건 중 이미 한 기준에 미달하는 셈이다.
그러면서 ‘개정 이전 개발에 착수한 의약품에 소급적용하지 않는다’는 기준을 따로 명시하지 않아 혼란을 예고했다. 코오롱생명과학 관계자는 “허가는 정부의 권한으로 함부로 얘기할 수 없다”면서도 “회사 내부적으로 굉장히 우려하고 있는 것은 사실”이라고 말했다.
지난해 12월 문정림 새누리당 국회의원(비례대표)이 이 같은 문제를 해소하기 위해 생명윤리법 개정안을 발의했지만 논의조차 안되고 있다. 문 의원은 두 가지 중 하나의 조건만 충족하면 유전자 치료제 연구를 할 수 있도록 완화했다.
◆치료제 개발 ‘美 1357건, 韓 17건’
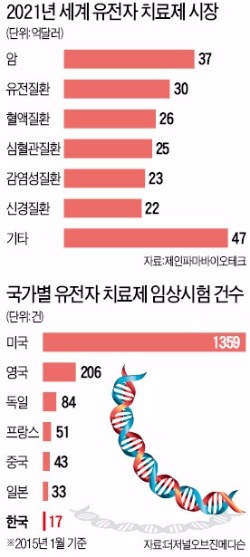
국내에서는 바이로메드, 제넥신 등 바이오기업들이 유전자 치료제 개발에 뛰어들었지만 세계적 수준에 한참 뒤처져 있다. 유전자 치료제 개발을 위한 임상시험은 세계에서 2142건(올 1월 기준) 이뤄지고 있다. 한국은 17건에 불과하다. 미국(1359건) 영국(206건) 독일(84건) 프랑스(51건) 등 선진국에 비해 크게 적다. 중국(43건)에도 못 미친다.
업계에서는 연구할 수 있는 질병에 제한을 둔 규정부터 풀어야 한다고 요구하고 있다. 선진국에서는 심혈관 질환, 감염성 질환, 파킨슨 질환, 안질환 등 다양한 질병에 대한 유전자 치료제 연구를 허용하고 있다. 일본도 올해 ‘유전자 치료 임상 연구에 관한 지침’에서 치료 대상 질환을 명시한 조항을 삭제했다.
■ 유전자 치료제
gene medicine. 잘못된 유전자를 정상 유전자로 바꾸거나 치료 효과가 있는 유전자를 재료로 하는 치료제.
조미현 기자 mwise@hankyung.com

![[포토] 한국 한정 발렌타인 싱글몰트 글렌버기 스몰배치 16년 공개](https://img.hankyung.com/photo/202411/01.38771794.3.jpg)

