[한민수의 약 파는 이야기⑤]한미약품 다음 타자는 누구?…기술이전의 징후들, 바이로메드와 인트론바이오
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
![[한민수의 약 파는 이야기⑤]한미약품 다음 타자는 누구?…기술이전의 징후들, 바이로메드와 인트론바이오](https://img.hankyung.com/photo/201512/01.10941700.1.jpg)
3일 업계에 따르면 바이로메드에 대한 기대감이 있다. 바이로메드는 유전자치료제 중심의 신약개발 전문업체다. 바이로메드의 주력 신약후보물질(파이프라인)인 'VM202'는 세포 성장에 관여하는 유전자를 발현시켜 새로운 신경세포 및 혈관의 형성을 유도한다.
이같은 작용구조(기전)를 가지고 있는 'VM202-DPN'(당뇨병성 신경통증)과 'VM202-PAD'(허혈성 족부궤양)는 모두 미국 식품의약국(FDA)의 임상3상 시험을 승인받았다. DPN은 현재 3상 시험을 위한 병원을 모집하는 단계이고, PAD는 3상 시작을 준비 중이다.
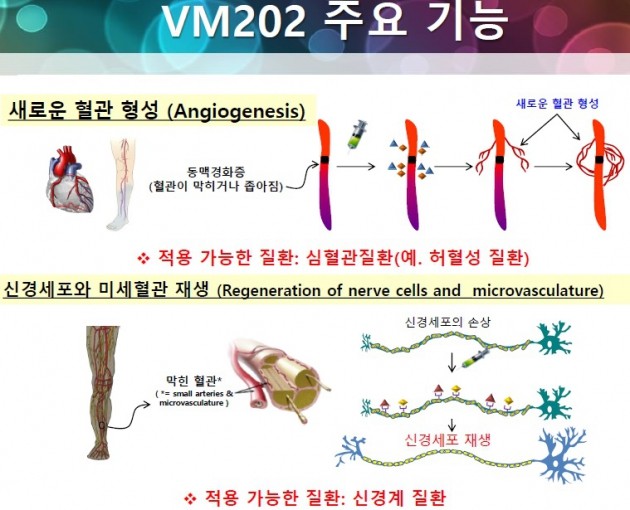
바이로메드는 올 5월 기업설명회(NDR·Non Deal Roadshow)를 통해 임상3상의 비용을 기술이전 대상 회사를 통해 마련할 것이라고 설명한 바 있다. DPN은 지난 4월 3상에 진입했다. 임상3상은 통상적으로 임상에 참여할 병원과 의료진 선정, 환자모집 등에 1년이 소요된다. 이후 본격적으로 임상비용이 들어가는 약물투여가 시작되는 것이다.
때문에 내년 4~5월 DPN의 환자 대상 약물투여가 시작되고, 바이로메드는 그 이전에 기술이전을 성사시킬 것으로 기대되고 있다.
바이로메드 관계자는 "글로벌 제약사들과 관련 협상을 하고 있고, 얘기들이 잘 되고 있다"며 "환자 투여 이전에는 기술이전을 할 계획이지만, 실제 계약 시기를 확정하기는 어렵다"고 말했다.
인트론바이오는 슈퍼박테리아 항생제 신약후보물질인 'N-Rephasin SAL200'을 가지고 있다. 이 파이프라인은 임상1상을 완료하고, 한국 식품의약품안전처의 임상2상 승인을 기다리고 있다.
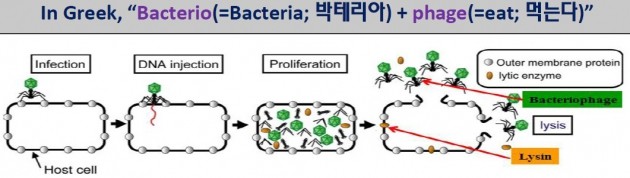
SAL200이 주목받고 있는 이유는 새로운 기전으로 기존 합성의약품 항생제의 내성균 문제를 극복할 가능성이 크다는 것이다. SAL200은 '세균(박테리아)을 잡아 먹는 미생물'인 박테리오파지의 유전체 정보로부터 개발된 엔도리신(Endolysin)을 유효성분으로 한다.
세균의 천적인 박테리오파지에서 나온 엔도리신은 기존 합성항생제의 세포벽 합성 저해 방식과 달리 세포벽을 파괴한다. 합성항생제는 박테리아 증식을 막는 과정에서 내성균을 발생시키지만, SAL200은 박테리아 자체를 파괴하는 것이다.
이 법은 신규 항생제에 대한 우선심사, 신속심사, 5년 추가 독점권 부여 등을 골자로 하고 있다. 법 제정 이후 글로벌 제약사들은 자신들에게 없는 신규 항생제 파이프라인 찾기에 몰두하고 있다. 이를 가속화시킨 것이 글로벌 제약사 머크가 항생제 전문업체 큐비스트를 2014년 12월 약 10조원(95억달러)에 인수한 사건이었다.
내성 문제 외에도 SAL200에 대한 기대가 큰 것은 항생제가 다른 신약에 비해 임상 성공확률이 높기 때문이다. 항생제는 인체 대사과정에 연관되는 일반약과 달리 세균만을 대상으로 하기 때문에 동물시험(전임상)의 약효가 사람에게서도 나타날 가능성이 높다.
시장조사기관 IDSC에 따르면 임상2상 이후 다음 임상단계 진입 성공률은 일반약이 28%였던데 반해 항생제는 75%로 월등히 높았다.
윤경원 인트론바이오 대표이사 부사장은 "SAL200은 현재 글로벌 제약사와 기술이전과 관련해 여러가지 조건에 대해 협의하고 있다"고 말했다.
한민수 한경닷컴 기자 hms@hankyung.com

![11월 둘째 주, 마켓PRO 핫종목·주요 이슈 5분 완벽정리 [위클리 리뷰]](https://img.hankyung.com/photo/202411/99.34900612.3.jpg)
!['트럼프 트레이드' 차익 실현·Fed정책 불확실성에 3대지수 동반 하락 [뉴욕증시 브리핑]](https://img.hankyung.com/photo/202411/ZA.38636746.3.jpg)
![헬스케어 12% 박살난 이유 [김현석의 월스트리트나우]](https://img.hankyung.com/photo/202411/01.38661785.3.png)