셀트리온은 미국 식품의약국(FDA)에 제출한 유방암 치료제 허쥬마(성분명 트라스트주맙)의 품목허가 신청이 지난 28일 받아들여졌다고 31일 밝혔다. 램시마, 트룩시마에 이어 세계 최초로 개발한 퍼스트 무버(선도자) 바이오시밀러를 모두 미국 시장에 투입하는 것이다.
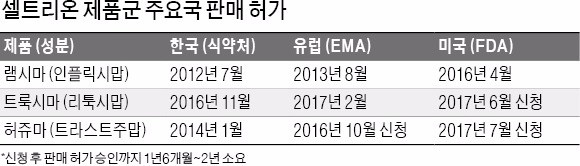
허쥬마는 올 하반기 국내 출시를 앞두고 있다. 유럽과 일본에서도 각각 작년 10월과 올 4월 품목 허가를 신청해 판매 허가를 기다리고 있다. 셀트리온은 내년 상반기 허쥬마와 트룩시마의 FDA 승인을 획득하고 하반기부터 본격적으로 판매에 나설 계획이다. 기우성 셀트리온 대표는 “허쥬마는 풍부한 임상 데이터를 바탕으로 오리지널 제품과 동등한 안전성 및 유효성을 입증했다”며 “경쟁 제품보다 우월한 임상 결과로 미국 시장을 선점하겠다”고 말했다.
업계는 셀트리온의 후속 제품도 램시마처럼 돌풍을 일으킬지 주목하고 있다. 작년 말 미국에 출시된 램시마는 올 2분기 2135만달러(약 240억원)가 처방돼 판매액이 1분기(671만달러) 대비 약 218% 늘었다. 셀트리온 관계자는 “제품군 중 ‘맏형’인 램시마가 유럽에서 3년간 처방 데이터를 쌓으면서 바이오시밀러에 대한 의사와 환자의 신뢰를 얻었다”며 “후속 제품은 ‘램시마 효과’에 힘입어 시장에 빨리 안착할 수 있을 것”이라고 말했다.
전예진 기자 ace@hankyung.com








![[속보] 배우 김새론, 자택서 숨진 채 발견…경찰 조사 중](https://img.hankyung.com/photo/202502/BF.38468293.3.jpg)