약물 주사 없이 알츠하이머 치료 시대 열릴까
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
김종기 대구가톨릭대 연구팀 "투과성 양성자 이용 신경독성 분쇄"
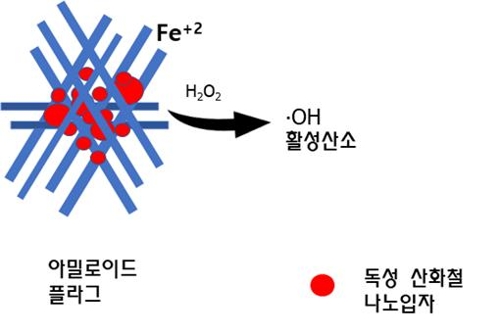
한국연구재단은 김종기 대구가톨릭대 교수 연구팀이 투과성 양성자를 이용해 알츠하이머성 뇌 신경독성을 제거·분쇄하는 가능성을 제시했다고 3일 밝혔다.
알츠하이머 치매 신경독성은 베타 아밀로이드와 타우 단백질 응집 영향으로 발생한다고 알려졌다.
아밀로이드와 타우 단백질이 산화철 나노입자와 복합체를 형성할 때, 반응성이 큰 2가 철 이온으로 인해 활성산소가 만들어 지면서 독성이 유발된다는 원리다.
연구팀은 투과성이 있는 양성자를 뇌 병변에 쏴 정상 세포 손상 없이 신경독성을 제거하는 '쿨롱 나노킬레이트' 치료법을 개발했다.
이 기술은 아밀로이드 플라그와 타우 매듭을 동시에 제거할 수 있다.
둘 중 하나만 표적으로 삼는 기존 연구 내용과는 다르다.

베타 아밀로이드와 산화철 결합체가 타우 응집체 주성분이어서 양성자에 의해 동시에 분쇄될 수 있다고 연구팀은 설명했다.
김종기 교수는 "앞으로 생체모델을 이용해 알츠하이머 환자 뇌 타우 매듭의 그리드 세포 손상 경로를 살필 계획"이라며 "인지기능 회복과 치료 안전성에 대한 연구도 이어갈 것"이라고 말했다.
연구는 과학기술정보통신부·한국연구재단 방사선기술개발사업 지원으로 수행했다.
성과를 담은 논문은 '케임브리지 재료연구회 교신(MRS communications)' 6월 15일 자에 실렸다.
/연합뉴스

알츠하이머 치매 신경독성은 베타 아밀로이드와 타우 단백질 응집 영향으로 발생한다고 알려졌다.
아밀로이드와 타우 단백질이 산화철 나노입자와 복합체를 형성할 때, 반응성이 큰 2가 철 이온으로 인해 활성산소가 만들어 지면서 독성이 유발된다는 원리다.
연구팀은 투과성이 있는 양성자를 뇌 병변에 쏴 정상 세포 손상 없이 신경독성을 제거하는 '쿨롱 나노킬레이트' 치료법을 개발했다.
이 기술은 아밀로이드 플라그와 타우 매듭을 동시에 제거할 수 있다.
둘 중 하나만 표적으로 삼는 기존 연구 내용과는 다르다.

김종기 교수는 "앞으로 생체모델을 이용해 알츠하이머 환자 뇌 타우 매듭의 그리드 세포 손상 경로를 살필 계획"이라며 "인지기능 회복과 치료 안전성에 대한 연구도 이어갈 것"이라고 말했다.
연구는 과학기술정보통신부·한국연구재단 방사선기술개발사업 지원으로 수행했다.
성과를 담은 논문은 '케임브리지 재료연구회 교신(MRS communications)' 6월 15일 자에 실렸다.
/연합뉴스



![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


