까다로운 'FDA 승인' 잇단 도전… K바이오 '美 상륙작전' 속도 낸다
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
제약·바이오
셀트리온·대웅제약·녹십자 등
美 FDA의 '신약 허가' 재도전
코오롱티슈진, 임상 3상 돌입
SK바이오팜·삼성바이오에피스
이르면 연내 판매 승인 가능성
셀트리온·대웅제약·녹십자 등
美 FDA의 '신약 허가' 재도전
코오롱티슈진, 임상 3상 돌입
SK바이오팜·삼성바이오에피스
이르면 연내 판매 승인 가능성

고배 마셨던 제약사들의 재도전
올해는 FDA의 깐깐한 심사 조건을 충족하지 못했던 기업들이 재도전한다. 셀트리온은 지난 6월 바이오시밀러 ‘허쥬마’의 품목 허가를 위한 추가 보완자료를 FDA에 제출했다. 대웅제약도 2일 보툴리눔 톡신 ‘나보타’의 허가를 받기 위해 보완 자료를 제출했다. FDA가 두 회사에 최종 보완요구공문(CRL)을 요구한 데 따른 것이다. 허쥬마는 올 하반기, 나보타는 내년 승인을 받을 것으로 예상된다.
GC녹십자도 면역 결핍증 치료제 ‘IVIG-SN’의 FDA 허가를 기다리고 있다. 지난해 미국 허가가 나올 것으로 예상됐지만 FDA로부터 제조 공정상 문제를 지적받아 허가가 지연됐다. GC녹십자는 문제를 보완하고 서류를 제출해 연내 최종 허가를 받을 것으로 기대하고 있다.
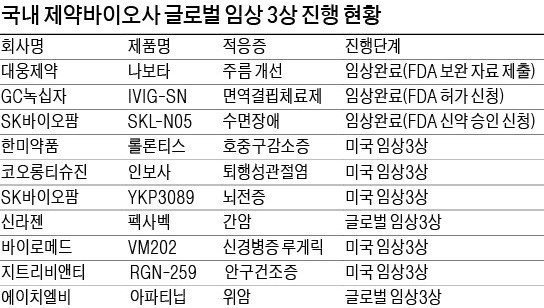
미국에서 환자를 대상으로 임상 3상에 속도를 내는 회사도 있다. 코오롱티슈진은 지난달 미국에서 골관절염 치료제 ‘인보사’의 임상 3상에 돌입했다. 미국에서는 연골재생 여부를 입증해 근본적치료제로 허가받는다는 계획이다. 2021년까지 미국 내 품목 허가를 받는 게 목표다. 한미약품이 2012년 미국 스펙트럼에 기술수출한 호중구감소증 치료제 ‘롤론티스’는 임상 3상 결과가 최근 발표됐다. 경쟁 약물인 ‘뉴라스타’와 부작용 발현이 비슷했지만 약물 안전성이 높은 것으로 나타났다. 스펙트럼은 올 4분기에 FDA 허가를 신청할 계획이다.
바이로메드의 당뇨병성 신경병증 유전자치료제 ‘VM202’는 미국 임상 3상 막바지 단계에 접어들었다. 바이로메드는 미국 DNA 생산시설을 인수하고 제품 상용화를 준비하고 있다. 신라젠의 항암바이러스 치료제 ‘펙사벡’은 내년 말 임상 종료를 목표로 말기 간암 환자를 대상으로 글로벌 임상 3상을 진행 중이다. 하반기에는 임상 중간 결과를 발표할 예정이어서 주목된다.
SK바이오팜과 삼성바이오에피스는 임상 3상을 이미 완료하고 허가를 기다리고 있다. SK바이오팜의 수면장애 치료제 ‘SKL-N05’는 지난 3월 FDA의 승인 검토에 들어가 이르면 연내 허가를 받을 것으로 보인다. 삼성바이오에피스의 허셉틴 바이오시밀러 ‘온트루잔트’는 지난해 12월 FDA에 판매 허가 신청해 심사 중이다. 유럽에서는 지난해 11월 허가를 받고 판매하고 있다.
전예진 기자 ace@hankyung.com



![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


