[인터뷰+]박순재 알테오젠 대표 "연내 아일리아 시밀러 美 협력사 선정 기대"
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
![[인터뷰+]박순재 알테오젠 대표 "연내 아일리아 시밀러 美 협력사 선정 기대"](https://img.hankyung.com/photo/201808/01.17618172.1.jpg)
지난 16일 공덕 서울사무소에 만난 박순재 알테오젠 대표(사진)는 연내 성과가 기대되는 의약품 후보물질로 아일리아 바이오시밀러를 꼽았다. 알테오젠은 현재 일본 키세이제약과 황반변성 치료제인 아일리아의 바이오시밀러를 공동 개발하고 있다.
미국에서 실시한 동물(비임상) 실험을 통해 아일리아와의 동등성을 확인했다. 내년 임상 1상 시험에 들어가기 위해 준비 중이다. 일본 판권은 키세이제약이, 한국 판권은 알테오젠이 갖는다. 미국과 유럽 권리는 기술수출할 계획이다. 시장조사기관 스태티스타에 따르면 아일리아는 지난해 세계에서 60억달러(약 6조7000억원) 이상의 매출을 올린 초대형 의약품이다.
박 대표는 "세계 최초의 아일리아 바이오시밀러를 예상하는 이유는 개발 속도가 가장 빠르고, 우리가 독자적인 제형 특허를 취득했기 때문"이라고 말했다.
리제네론과 바이엘이 개발한 아일리아의 물질특허는 일본 2022년, 미국 2023년, 한국 2024년, 유럽 2025년에 만료된다. 의약품에서 물질특허란 약효를 나타내는 물질에 대한 것으로 복제약의 경우 물질특허가 만료되기 이전 출시가 불가능하다.
또 아일리아는 2027년부터 2030년까지의 제형특허를 가지고 있다. 의약품이 효과를 나타내기에 적합한 형태에 대한 특허다. 알테오젠은 이 특허를 회피할 수 있는 고유의 제형 특허를 미국과 한국에 등록했다. 아일리아 제형특허 만료 이전에 미국은 물질특허가 끝나는 2023년, 한국은 2024년 이후 아일리아 바이오시밀러를 출시할 수 있다는 얘기다. 유럽과 일본 등 12개국에도 제형특허가 출원된 상태다.
◆허셉틴 ADC 기술수출 논의, 연말 이후 본격화
가장 파괴력이 클 것으로 기대하는 신약후보물질은 'ALT-P7'이다. 유방암 치료제 허셉틴에 알테오젠의 항체약물접합(ADC) 기술을 적용했다. ADC는 암세포 등 특정 세포를 표적할 수 있는 항체에 독성을 가진 약물을 붙이는 차세대 신약 기술이다. 원하는 부위에서만 독성을 나타내기 때문에 더 많은 용량을 사용해 약효를 높일 수 있다.
박 대표는 "알테오젠의 ADC 기술인 '넥스맙'은 2세대 기술로 약물을 항체의 말단 위치에만 붙일 수 있다"며 "1세대 기술은 항체에 붙는 약물의 위치를 특정할 수 없어 체내 안전성이 떨어지고, 생산수율도 낮았다"고 말했다.
ALT-P7은 현재 국내에서 유방암 환자를 대상을 임상 1상을 진행 중이다. 쥐를 대상으로 한 동물실험에서 1세대 ADC 기술이 적용된 로슈의 캐사일라보다 유방암과 위암에서 우수한 치료 효과를 보였다. ALT-P7은 지난달 미국 식품의약국(FDA)으로부터 위암 치료 희귀의약품으로도 등록됐다. 캐사일라는 위암 치료제로는 허가받지 못했다.
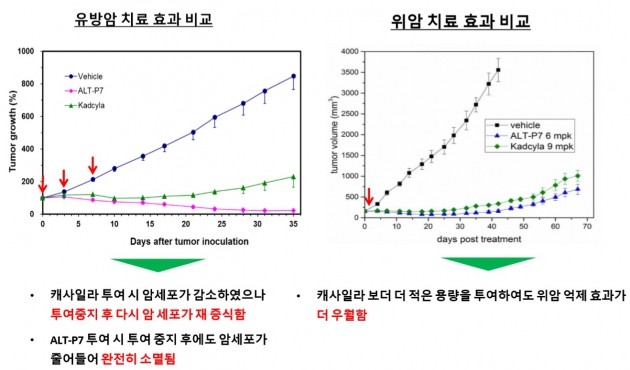
◆"국내외 기업과 협력 속도 높일 것"
알테오젠은 넥스맙 외에도 의약품의 약효 지속시간을 늘리는 '넥스피' 기술을 가지고 있다. 넥스피를 성장호르몬에 적용한 'ALT-P1'은 성인용에 대한 국내 임상 2a상을 완료했다. 경쟁 지속형 성장호르몬에 비해 10~50% 수준의 용량으로도 효과를 나타내기 때문에 시장 경쟁력을 갖출 것으로 보고 있다. 국내는 임상 2b상, 유럽에서는 소아용 임상을 준비 중이다.
넥스맙과 넥스피는 모두 다양한 질환 치료제에 적용할 수 있는 기반(플랫폼) 기술이다. 알테오젠은 두 가지 플랫폼 기술을 이용해 국내외 제약사들과의 협력에 속도를 낸다는 방침이다.
박 대표는 "플랫폼 기술 역시 특허기간이 있다"며 "특허기간 내에 알테오젠 혼자서 다양한 치료제를 개발하는 데는 한계가 있기 때문에 협력을 통해 개발 제품의 영역을 확장할 것"이라고 말했다.
한민수 한경닷컴 기자 hms@hankyung.com
ADVERTISEMENT
ADVERTISEMENT





![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


