유전자 치료 연구범위 확대 ‘보류’…심의위 “추가 논의 거치겠다”
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
DTC 범위 확대 안건도 수정해 재상정
업계 “또 언제 심의위 소집하나” 한숨
업계 “또 언제 심의위 소집하나” 한숨

◆심의위 “결정 보류하고 추가 논의”
심의위가 29일 서울 반포동 쉐라톤서울팔래스강남호텔에서 정기회의를 열고 안건 가결 여부를 논의했으나 결론을 내지 못했다. 심의위는 회의 직후 “유전자와 잔여배아를 이용하는 치료법 연구 안건에 대해 결정을 유보하고 향후 보다 심도 깊은 논의를 진행하기로 했다”고 설명했다. 이어 “DTC 유전자 검사 제도 개선 안건은 기존 상정안을 폐기하고 보다 합리적인 방안을 검토하기로 했다”며 “인증제와 범위 확대를 분할해 신중하게 검토할 예정”이라고 했다.
복지부 관계자는 “논의할 내용이 많지만 시간이 늦어 다음에 회의를 다시 열고 추가 논의하기로 한 것”이라고 설명했다. 다음 회의 날짜는 아직 정해지지 않았다. 심의위는 ‘생명윤리 및 안전에 관한 법률’(생명윤리법)에 따라 설치된 민관 합동 논의기구로 △대통령이 소집을 요구할 때 △재적위원 3분의 1 이상이 소집을 요구할 때 △위원장이 필요하다고 인정할 때 본회의를 열 수 있다. 실제로는 1년에 한 번 정도 열린다.
당초 심의위는 이날 유전자 이용 치료법 연구에 대한 규제 완화안을 가결하려고 했으나 이견이 많아 결론을 내지 못한 것으로 알려졌다. 당초 복지부도 가결을 염두에 두고 후속 조치를 준비했던 것으로 전해졌다.
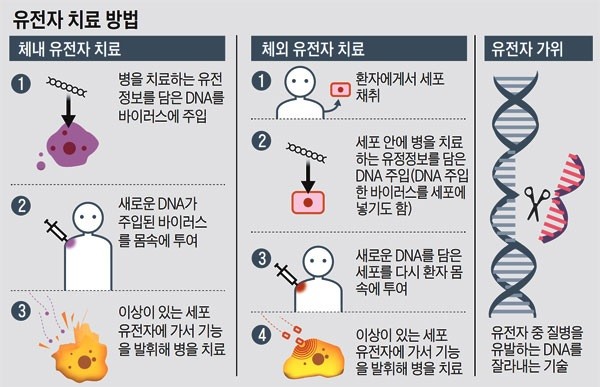
현행 생명윤리법 제47조 1항 1호는 “유전질환, 암, 후천성면역결핍증, 그 밖에 생명을 위협하거나 심각한 장애를 불러 일으키는 질병의 치료를 위한 연구”를 할 때만 유전자를 이용한 치료법을 연구할 수 있도록 제한한다. 같은 항 2호는 “현재 이용 가능한 치료법이 없거나 유전자 치료의 효과가 다른 치료법과 비교해 현저히 우수할 것으로 예측되는 치료를 위한 연구”에 한해 관련 연구가 가능하도록 했다.
사람의 몸 속에서 인위적으로 유전적 변이를 일으켜 병을 치료하는 방법에 대한 연구는 1호와 2호를 동시에, 몸 밖에서 유전자 변형 세포를 만들어 몸 안으로 집어넣는 치료는 1호와 2호 중 하나를 충족시켜야 시행할 수 있다. 심의위는 이 가운데 대상 질환의 범위를 정한 1호를 삭제하거나 대폭 완화하는 방안을 검토했던 것으로 전해졌다.
잔여배아 이용 연구에 대해서도 유사한 내용의 제도 개선안을 검토한 것으로 알려졌다. 생명윤리법 29조는 뇌성마비 등 22가지 희귀·난치성 질병에 대한 치료법 연구를 위해서만 잔여배아를 이용할 수 있도록 했다. 심의위는 이 제한을 완화하는 방안을 검토했으나 결론을 내지 못했다. 잔여배아는 체외수정을 목적으로 생성된 배아 가운데 임신에 이용하고 남은 것을 말한다.
◆美日 등 선진국은 범위 제한 안해
유전자 치료 연구의 범위와 관련해 미국과 유럽연합(EU)은 별도의 제한 규정을 두고 있지 않다. 일본은 ‘유전자 치료 임상 연구에 관한 지침’을 통해 한국과 유사한 가이드라인을 두고 있었으나 2015년 대상 질환의 범위에 대한 조항을 삭제했다. 현재는 △임상연구 결과 다른 치료법보다 우수할 것으로 예측되고 △임상시험 참여자가 얻는 이익이 불이익보다 클 경우 승인을 거쳐 유전자 이용 치료를 연구할 수 있다.
잔여배아 이용 연구도 비슷하다. 세부 규정은 나라마다 다르지만 미국, 영국, 일본, 프랑스 등 상당수의 선진국이 대상 질환 범위를 제한하지 않고 있다.
한국에서는 유전자 치료 연구를 하려면 각 연구기관, 대학, 병원 등에 설치된 기관생명윤리위원회(IRB)의 심의만 통과하면 된다. 그러나 미국 유럽 일본 등에서는 국가기관의 심의를 통과해야 한다. 선진국이 연구 범위 제한을 하지 않되 모니터링은 투명하게 하는 편이다. 업계 관계자는 “심의위가 선진국처럼 국가 차원 기구의 심의를 거치토록 하는 방안을 염두에 두고 있었던 것으로 안다”고 말했다.
DTC와 관련해서는 앞서 복지부 산하 ‘DTC 유전자검사 제도개선 민관협의체’가 검사실 인증제를 전제 조건으로 검사 허용항목 확대를 추진하는 방안을 의결했다. 신뢰도 있는 검사 기관에 한해서 다양한 검사를 할 수 있도록 제한을 풀어주자는 취지다. 병원을 거치지 않는 유전자 검사인 DTC는 현재 탈모 비만 등 일부 웰니스(건강 상태) 분야에서만 제한적으로 가능하다. 그러나 심의위는 민관협의체 결정을 뒤집었다.
양병훈 기자 hun@hankyung.com



