램시마 이어 트룩시마까지…셀트리온, 美 퍼스트무버 꿰차
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
美 FDA 자문위 승인 권고
오리지널 '리툭산'과 동등성 확인
최종 승인 이르면 11월 말 예상
年 5조원대 시장 개척 기대감
오리지널 '리툭산'과 동등성 확인
최종 승인 이르면 11월 말 예상
年 5조원대 시장 개척 기대감
11일 셀트리온에 따르면 미국 식품의약국(FDA) 항암제 자문위원회는 셀트리온과 FDA, 민간 전문가 및 환자 단체의 의견을 들은 뒤 논의를 거쳐 표결했다. 표결에서 자문위원 16명 전원의 만장일치로 승인 권고안이 채택됐다. 자문위는 표결 뒤 “트룩시마와 오리지널 의약품은 신뢰할 수 있는 임상 데이터를 바탕으로 생물학적 동등성과 안전성 면에서 고도로 유사함을 확인할 수 있었다”고 발표했다.
이번 승인 권고에 따라 셀트리온은 조만간 FDA의 최종 승인을 받을 수 있을 것으로 기대하고 있다. 시기는 11월 말에서 12월 초로 예상된다. 승인 시 트룩시마는 미국에서 최초로 허가받는 리툭산 바이오시밀러가 될 전망이다. 현지 판매는 다국적 제약사 테바가 맡는다. 구체적인 출시 일정은 아직 나오지 않았다.
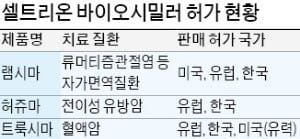
바이오시밀러 시장 주도권 경쟁은 한층 뜨거워질 전망이다. FDA의 허가를 받은 바이오시밀러는 지금까지 총 12개다. 화이자가 마일란 등 3개, 암젠이 엠바시 등 2개의 바이오시밀러 허가를 받았다. 셀트리온은 트룩시마의 최종 허가를 눈앞에 두면서 화이자 암젠 등 다국적 제약사들과 어깨를 나란히 하게 됐다.
2016년 12월 미국에 출시된 램시마(미국명 인플렉트라) 매출은 지난해 1분기 1700만달러에서 올해 2분기 6300만달러로 급성장했다. 오리지널 의약품인 레미케이드 시장에서 차지하는 비중은 아직 5~6% 수준이다. 유럽 점유율이 50%를 넘어선 것과 대조적이다. 셀트리온 관계자는 “램시마에 이어 트룩시마까지 가세하면 미국 시장 공략에 시너지 효과가 클 것으로 기대한다”고 말했다.
셀트리온은 미국 정부가 최근 예고한 바이오시밀러 확대 정책이 미국 시장 점유율 확대에 우호적인 환경을 조성해줄 것으로 기대하고 있다. 미국 정부는 최근 바이오시밀러 육성정책(BAP)을 발표했다. 바이오시밀러 도입을 촉진해 가격 인하와 제품 개선을 유도하겠다는 취지다.
양병훈 기자 hun@hankyung.com
ADVERTISEMENT
ADVERTISEMENT






![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


