뇌졸중 약 개발하는 韓 제약사들…연말에 임상 중간결과 나온다
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트

◆신풍제약, 2b상 신청…제일약품, 2a상 중간 발표
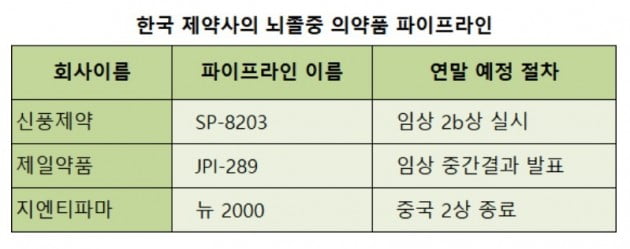
신풍제약(사진)은 이르면 31일 뇌졸중 신약 후보물질(파이프라인) ‘SP-8203’에 대한 임상 2b상 허가 신청을 식품의약품안전처에 낼 예정이다. 식약처의 자료 보완 요구가 없으면 다음달 말께 허가 여부가 결정날 것으로 보인다. 신풍제약은 앞서 국내에서 환자 80명을 대상으로 2a상을 했다. 회사 관계자는 “2a상에서 안전성을 확인한 만큼 2b상에서는 환자군을 대폭 늘려 유효성을 입증하는데 주력할 것”이라고 말했다.
제일약품은 뇌졸중 치료제 ‘JPI-289’의 2a상에 대한 코호트2(세부 2단계) 결과를 다음달 발표한다. 이 회사는 지난 10개월간 서울대병원을 비롯한 국내 11개 의료기관에서 환자 15명을 대상으로 코호트2를 진행했다. 코호트1보다 투약량을 늘려 안전성과 일부 유효성을 시험했다. 앞서 이 후보물질은 정부 범부처신약개발사업단에서 연구비를 지원받았다. 제일약품 관계자는 “임상 결과가 좋아 데이터 정리가 순조롭게 진행 중”이라고 했다.
SP-8203와 JPI-289의 적응증인 ‘허혈성 뇌졸중’은 뇌혈관이 막혀 생기는 병이다. 이들 후보물질은 막힌 혈관을 뚫어주는 혈전용해제(tPA)와의 병용투여 용법으로 개발된다. 현재 tPA로는 베링거인겔하임의 ‘액티라제’가 가장 널리 쓰인다. 액티라제는 보통 발병으로부터 3~4시간 반 이내에 투약해야 하는데 SP-8203는 이 ‘골든타임’을 6시간까지로 늘리고 부작용을 줄이는 게 목표다. JPI-289은 환자가 치료 뒤 언어·행동장애를 겪을 가능성을 낮춰주는 약으로 개발되고 있다.
바이오벤처기업 지엔티파마는 뇌졸중 치료 후보물질 ‘뉴 2000’에 대한 중국 임상 2상을 오는 연말에 마무리할 전망이다. 이 회사는 중국에서 환자 219명을 대상으로 임상 2상을 해왔다. 이밖에 한국에서도 8시간 이내에 혈전제거 수술을 받는 뇌졸중 환자 118명을 대상으로 2상을 진행중이다. 병용투여가 아닌 단독투여가 목표다.
지엔티파마 관계자는 “뇌졸중은 신경전달물질 ‘글루타메이트’가 과다분비돼 생긴다”며 “tPA로 혈관을 뚫으면 뇌에 활성산소가 갑자기 많이 들어가 뇌세포가 죽는 부작용도 있다”고 말했다. 이 관계자는 “대부분의 뇌졸중 의약품은 둘 중 하나를 막는 게 목표인데 뉴 2000은 둘 모두에 효과가 있어 치료 성공 확률이 더 높다”고 주장했다.
◆“뇌졸중 의약품 시장규모 급성장”
국내 제약사들은 개발 중인 후보물질을 끝까지 직접 개발하지 않고 라이선스아웃하는 게 목표다. 임상 환자 수를 충분히 확보하고 데이터를 축적해 약효에 대한 설득력을 높이는 게 성공의 관건으로 꼽힌다. 지엔티파마는 2009년 중국 헝뎬그룹의 계열사 아펠로아제약과 공동연구 계약을 맺으며 “2상이 성공적으로 끝나면 중국 내 판권을 아펠로아제약이 인수한다”는 내용을 넣었다. 신풍제약과 제일약품은 아직 협상중이다.
지금까지 미국 식품의약국(FDA)의 승인을 받은 뇌졸중 의약품은 액티라제가 유일하다. 글로벌 제약사들이 앞다퉈 뇌졸중 의약품 개발에 도전했지만 FDA 임상에 들어간 220개 물질 모두 고배를 마셨다. 업계 관계자는 “세계 허혈성 뇌졸중 치료제 시장 규모는 지난해 기준 1조4000억 원에 달하며 오는 2020년까지 약 2조3000억 원으로 확대될 전망”이라며 “사회가 고령화되는 만큼 앞으로 부가가치는 더 커질 것”이라고 말했다.
양병훈 기자 hun@hankyung.com



![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


