美 FDA 허가 대기 중인 국산 의약품 '사상 최대'
복제약 넘어 신약까지 美 상륙
작년 허가된 4개 모두 복제약
올해는 한미약품·SK바이오팜 등 블록버스터급 신약 3개도 대기
"포스트 반도체, 나야 나"
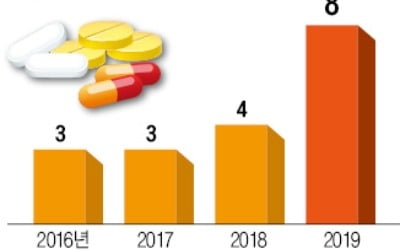
국내 독자개발 의약품 6개 달해, 양과 질 성장…경쟁력 '퀀텀점프'
바이오산업 캐시카우 역할 본격화

5년 만에 국산 신약 美 진출 기대
현재 FDA 심사 중인 국산약은 6개다. 허가 신청이 임박했거나 승인이 빠른 복제약까지 포함하면 올해 최대 10여 개의 국산 의약품이 FDA 심사 대상에 오를 것이란 전망도 나온다. 이 중 절반만 승인을 받아도 지난해 기록을 넘어선다. FDA 승인을 받으려면 허가 신청 서류를 제출한 뒤 1년간 의약품 제조 및 품질과 관련한 서류 심사와 공장 실사를 받아야 한다. 그동안 까다로운 FDA 심사를 통과하지 못해 미국 진출에 실패한 사례가 많았다. 최근에는 글로벌 제약사에 기술수출하거나 미국 현지에서 임상을 진행해 성공 확률을 높이고 있다.
SK바이오팜이 미국 재즈에 기술수출한 수면장애 치료제 솔리암페톨과 한미약품의 호중구감소증 치료제 롤론티스가 대표적이다. 두 제품 모두 복제약이 아니라 신약이라는 점에서 기대를 모으고 있다. 상업화에 성공하면 2014년 동아에스티의 항생제 시벡스트로 이후 5년 만에 FDA 허가를 받는 국산 신약이 나온다. 솔리암페톨은 SK바이오팜이 임상 1상을 끝낸 뒤 2011년 미국 재즈에 기술수출해 공동 개발했다. FDA 허가를 받으면 SK바이오팜은 재즈로부터 미국 판매 로열티를 받고 일본 중국 등 아시아 12개국의 판권을 통해 수익을 얻을 수 있다.
한미약품이 2012년 미국 스펙트럼에 기술수출한 롤론티스는 올 하반기 FDA 승인을 받을 것으로 예상된다. 롤론티스는 장기지속형 호중구감소증 바이오 신약이다. 한미약품은 뉴라스타의 글로벌 연 매출이 약 5조원에 달해 롤론티스도 블록버스터 제품으로 성장할 가능성이 있다고 보고 있다.

해외 제약사에 기술수출을 하지 않고 독자 개발한 제품으로 미국 시장에 도전하는 회사들도 있다. 올해 FDA 허가가 예상되는 8개 제품 중 국내 기업이 자체 개발한 제품은 6개다. 우리나라의 신약 개발 경쟁력이 ‘퀀텀점프’ 수준으로 급격히 도약했다는 평가가 나오는 배경이다. SK바이오팜이 독자 개발한 뇌전증 치료제 세노바메이트는 지난해 11월 허가를 신청해 심사가 이뤄지고 있다. SK바이오팜은 후보물질 개발부터 임상까지 직접 진행했고 생산과 유통도 자체적으로 한다는 계획이다.
GC녹십자와 대웅제약 등 ‘재수·삼수생’의 도전이 성공할지 여부도 주목된다. GC녹십자는 혈액제제 IVIG-SN으로 세 번째 도전에 나선다. 2015년 11월 FDA 허가를 신청했지만 2016년 말 제조공정과 관련한 보완 사항을 지적받았고 지난해 9월 또다시 보완 공문을 받으면서 허가가 지연됐다.
GC녹십자는 올해 FDA 허가에 사활을 걸고 있다. FDA 승인을 받아야 캐나다에 완공한 공장에서 생산한 제품을 북미 시장에 판매할 수 있어서다. GC녹십자 관계자는 “의약품의 효능과 안전성 문제가 아니기 때문에 이른 시일 안에 심사가 재개될 것으로 본다”고 말했다. 대웅제약이 개발한 보툴리눔 톡신 나보타도 FDA의 지적을 보완해 재심사를 신청했다. 제조공정에 문제가 없다면 올 하반기 허가를 예상하고 있다.
그동안 한국 바이오산업을 주도해온 바이오시밀러도 성과를 낼 전망이다. 지난해 셀트리온이 트룩시마와 허쥬마 허가에 성공했고, 올해는 삼성바이오에피스의 온트루잔트와 임랄디가 허가를 기다리고 있다. 허셉틴 바이오시밀러인 온트루잔트는 지난해 10월 바이오의약품허가신청(BLA) 심사기간 연장 통보를 받아 올초 허가가 날 전망이다.
박정태 한국바이오의약품협회 전무는 “그동안 미국 시장을 뚫은 우리나라 의약품은 복제약과 바이오시밀러가 많았지만 의약품 개발 기술 수준이 높아지면서 합성신약, 바이오신약까지 저변을 넓히고 있다”며 “FDA 허가를 받는 데 그치지 않고 미국 시장에서 성공한 신약이 나와야 한다”고 말했다.
전예진 기자 ace@hankyung.com