크론병 치료제 임상 지난해 두 배 늘어난 까닭은
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
자가면역질환 치료제 개발 기선 제압…성공하면 다른 질환으로

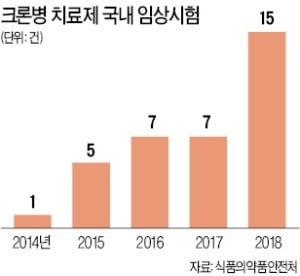
크론병은 아직 이렇다할 치료제가 없다. 환자의 목숨을 위협할 정도는 아니지만 생활 관리나 통증 등으로 삶의 질이 떨어질 수 있다. 건강보험심사평가원에 따르면 국내 크론병 환자는 약 2만6000명(2017년 기준)으로 추산된다.
지난해 임상 승인을 받은 곳은 대부분 글로벌 제약사다. 최근 브리스톨마이어스스큅(BMS)이 740억달러(약 83조4000억원)에 인수하기로 해 화제가 된 미국 세엘진이 ‘RPC1063 캡슐’로 4건의 승인을 받았다. 모두 3상이다. 글로벌 임상 대행기업 피피디디벨로프먼트피티이엘티디는 샤이어의 신약 후보물질(파이프라인) ‘SHP647’로 3상을, 한국애브비는 ‘ABT494’로 3b상을 3건씩 승인받았다.
신약을 시장에 내놓으려면 1상부터 3상까지 모두 세 단계의 임상시험을 거치며 약효와 안전성을 검증해야 한다. 3상을 하고 있다는 건 출시가 가까워졌다는 얘기다. 그러나 모두 성공하는 건 아니다. 미국바이오협회에 따르면 3상을 하고 있는 신약 후보물질(파이프라인)이 임상을 모두 통과해 시장에 최종 출시될 가능성은 58.1%다.
지난해 크론병 치료제 임상 승인을 받은 곳 가운데 국내 기업은 강스템바이오텍이 유일하다. 이 회사는 줄기세포를 활용한 치료제를 개발하고 있다. 변승재 강스템바이오텍 IR팀장은 “줄기세포를 면역 조절에 활용해 크론병의 원인을 근본적으로 치료하는 게 목표”라며 “손상된 부분을 사후적으로 재생하는데 초점을 맞추는 다른 크론병 치료제와 다르다”라고 말했다.
크론병 치료제 임상이 크게 늘어난 것은 이 치료제의 가능성이 크기 때문이다. 일단 크론병 치료제로 개발한 뒤 다른 자가면역질환으로 적응증을 확대할 수 있다는 것이다. 이승규 한국바이오협회 부회장은 “일단 시장에 약을 내놓은 뒤 임상 데이터를 보강해 아토피, 건선, 류머티즘관절염, 장기이식에 따른 거부반응, 만성폐쇄성 폐질환 등 다른 자가면역질환으로 적응증을 확대하겠다는 전략”이라고 말했다.
희귀질환관리법에 따른 정부의 개발 지원도 받을 수 있다. 이 법은 ‘희귀질환’을 환자 수가 2만명 이하인 병으로 정의한다. 크론병은 2만명이 넘었지만 여전히 이 법에 따라 희귀질환으로 분류된다. 의료보험 적용을 위한 질환코드 하나당 2만명 이하면 되는데 크론병은 대장, 소장, 대·소장 등 3가지로 구분돼 있어 환자 수가 분산되기 때문이다.
이 법은 정부와 지방자치단체가 관련 치료제를 개발하는 기업을 지원할 수 있다고 규정했다. 식약처는 희귀질환 치료제 개발사의 임상 인허가 절차가 빨리 진행될 수 있도록 관리하고 있다. 정윤택 제약산업전략연구원 원장은 “웬만한 큰 회사는 크론병 치료제 개발에 다 뛰어들었다”고 말했다.
양병훈 기자 hun@hankyung.com




![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


