항생제 내성 가진 '다제내성균' 신생아 감염되면 사망할 수도
이렇다 보니 국제적으로도 다제내성균 치료제 개발에 힘을 쏟고 있는데요. 2000년대 이후 11개의 슈퍼 항생제가 미국 식품의약국(FDA) 허가를 받았습니다. 달바반신, 테디졸리드, 오리타반신, 세프톨로잔-타조박탐, 세프타지딤-아비박탐, 메로페넴-버보박탐 등입니다. 그런데 이 중 국내에서 허가를 받은 제품은 두 개뿐입니다. 가격이 비싸거나 수익성이 없다고 판단해 다국적 제약사들이 국내에 들여오지 않고 있어서입니다. 동아에스티가 2015년 개발한 항생제 ‘시벡스트로’는 국내 허가를 받았음에도 정부와 약가 협상에서 원하는 가격을 받지 못해 출시가 지연되고 있죠.
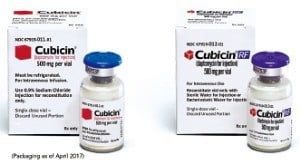
피해를 보는 건 국내 환자들입니다. 해외에서는 이미 슈퍼 항생제의 특허가 만료돼 가격을 낮춘 제네릭(복제약)들이 나오고 있습니다. 슈퍼 박테리아의 확산을 막기 위해 최소한의 ‘무기’를 달라고 의료계가 요구하는 이유입니다. 올해부터는 상황이 조금 나아질 것으로 보입니다. 슈퍼 항생제 복제약이 국내에 출시될 것이란 희소식이 전해졌는데요. 건일제약이 ‘큐비신(성분명 답토마이신)’ 제네릭의 국내 허가를 받아 오는 4월 출시할 예정입니다. 건일약품 외에 영진약품도 유럽 제약사가 개발한 큐비신 제네릭의 국내 발매를 준비하고 있는 것으로 알려졌습니다.

ace@hankyung.com


![[한경과 맛있는 만남] 김동만 이사장, 합기도 6단 '터미네이터' 별명…한국노총 위원장 등 노동운동 33년](https://img.hankyung.com/photo/201902/AA.18994150.3.jpg)