앱클론, 혈액암 CAR-T 치료제 임상 후보물질 도출 성공
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
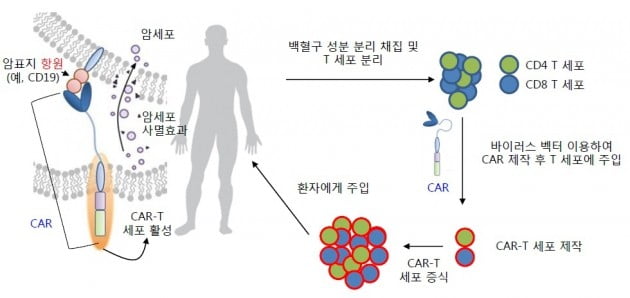
AT101은 B세포 유래 백혈병과 림프종 치료제다. 올해 안에 임상에 들어갈 예정이다. 설비 도입 등 GMP 생산 라인을 구축하고 주요 병원과 계약하는 등 사업화를 준비하고 있다.
AT101은 노바티스의 킴리아, 길리어드의 예스카타처럼 CD19 질환 단백질을 표적으로 한다. 이 회사의 경쟁력은 자체 개발한 플랫폼 기술을 바탕으로 해당 단백질의 다른 부위에 결합하는 새로운 항체를 이용함으로써 기존 CAR-T 치료제보다 면역원성을 제거했다는 점이다. 또 기존 CAR-T 치료제의 단점인 심각한 독성과 제한된 적응증을 극복할 수 있는 원천기술을 확보해 서울대 의대와 차세대 난소암 치료제를 개발 중이다.
세계 CAR-T 치료제 시장은 2017년 7200만달러에서 2028년 83억달러 규모로 성장할 전망이다. CAR-T 치료제 임상 1상 파이프라인을 보유하고 있던 카이트파마와 쥬노테라퓨틱스가 길리어드와 셀진에 각각 118억달러, 80억달러에 인수되는 등 CAR-T 치료제에 대한 관심이 높다.
이종서 대표는 "CAR-T 치료제는 혁신의약품이기 때문에 정부의 신약 개발 지원제도를 활용해 국내 최초로 AT101을 신속하 출시할 수 있을 것"이라고 말했다.
임유 기자 freeu@hankyung.com
![[종목썰쩐]'진짜' 조기진단기업 지노믹트리, IPO로 성장 본격화](https://img.hankyung.com/photo/201903/01.19091087.3.jpg)


![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


