종양 유발 논란 인보사…'허가 유지' 기로에
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
코오롱, 15일께 검사결과 발표
'신장유래세포' 종양 유발 우려에
코오롱측 "방사선 쬐어 암 사멸"
'신장유래세포' 종양 유발 우려에
코오롱측 "방사선 쬐어 암 사멸"
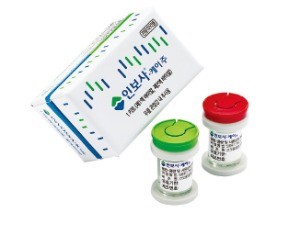
암 유발 가능성 두고 해석 분분
제약·바이오업계는 인보사를 개발하던 2004년과 현재 기술 수준의 차이로 신장유래세포임을 알 수 없었다는 회사 측 설명을 이해하기 어렵다는 반응이다. 연골유래세포와 신장유래세포는 모양과 염색체 수가 달라 기본적인 핵형 분석만으로도 알 수 있다는 점에서다. 김수정 코오롱생명과학 연구소장은 “세포를 형질전환하면 세포 모양과 염색체 수가 달라지기 때문에 구별하기 힘들다”며 “형질전환세포는 레트로 바이러스가 14개나 삽입돼 사실상 신장유래세포라고 볼 수 없다”고 설명했다.
일각에서는 애초에 계획했던 연골유래세포와 달리 신장유래세포가 종양을 유발할 가능성이 있다는 문제를 제기하고 있다. 신장유래세포가 의약품 성분으로 사용된 적이 없다는 점도 인보사의 안전성을 위협하는 요소다. 회사 측은 개발 단계부터 종양원성을 염두에 두고 임상을 진행했고 방사선을 쬐어 암이 생길 가능성을 원천 차단했다고 주장하고 있다. 미국 식품의약국(FDA)과 식품의약국안전처의 권고에 따라 안전성을 입증했다는 점도 강조했다. 세포가 사멸하는 것보다 높은 수준의 방사선량을 쬐고 세포 사멸 기간인 24일이 지난 뒤 44일 동안 완전 사멸이 확인된 제품만 출고했다고도 했다. 인보사 투여 부위가 혈관이 없는 관절강이어서 혈액을 통해 다른 장기로 약물이 전달될 우려가 없다는 점도 근거로 들었다. 유수현 코오롱생명과학 상무는 “연골유래세포를 사용했어도 형질을 전환하면 종양원성이 생긴다”며 “세포주의 기원이 연골세포에서 신장세포로 바뀐다고 해서 종양 유발 가능성이 커지는 것은 아니다”고 설명했다.

회사 측은 인보사의 임상 설계 과정에서 오류가 있었다는 점은 인정하고 있다. 그러나 임상 중간에 성분이 달라진 것이 아니고 개발부터 최종 제품까지 같은 성분을 사용했기 때문에 임상 데이터에는 문제가 없다고 주장하고 있다. 이와 관련해 식약처 내에서도 의견이 엇갈리고 있다. 허가 신청 서류에 기재한 성분과 이름이 달라졌으므로 절차적 요건상 허가 취소에 해당하지만 유전자 치료제의 특성을 감안해야 한다는 의견도 나오는 것으로 알려졌다. 허가가 취소될 경우 코오롱생명과학은 1000억원의 연구개발비와 공장 건설비 등의 손해가 불가피하다. 피해 보상을 요구하는 환자들이 집단소송을 제기할 수도 있다.
코오롱생명과학은 FDA에 관련 내용을 서면 보고한 뒤 향후 일정을 조율하고 있다. 대면 미팅을 통해 보완 자료를 제출하고 임상 3상 재개 여부를 논의할 예정이다. 회사 관계자는 “2016년 FDA가 세포주를 잘못 인식한 미국 바이오회사의 서류를 보완한 뒤 임상 2상 재개를 허용한 사례가 있어 긍정적인 결과를 기대하고 있다”고 말했다.
전예진 기자 ace@hankyung.com

![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


