13일 업계에 따르면 삼성바이오에피스는 중국의약품관리국(NMPA)에 항암제 'SB8'(성분명 베바시주맙)의 임상 3상 시험 계획을 신청하고 결과를 기다리고 있다. 회사는 올해 안에 임상 시험 계획이 승인될 것으로 기대하고 있다.
SB8은 전이성 대장암과 비소세포폐암 등의 치료에 쓰는 항암제 아바스틴의 바이오시밀러(바이오의약품 복제약)다. 삼성바이오에피스는 지난해 1월 중국 3S바이오와 SB8의 중국 내 판권을 위임하고 향후 임상, 허가, 상업화에 대해 협업하는 파트너십 계약을 체결했다.
올해 SB8의 임상시험까지 허가받으면 삼성바이오에피스는 중국에서 바이오시밀러 3종의 임상 3상 시험을 진행하게 된다. 삼성바이오에피스는 지난달 유방암 치료제 'SB3', 이달 희귀질환 치료제 'SB12'의 임상 3상 시험을 각각 허가받았다.
셀트리온은 중국에서 진행 중인 램시마(성분명 인플릭시맙) 임상 3상 시험 환자 등록을 완료했다. 셀트리온은 2017년 5월 중국 현지에서 램시마 임상 1상과 3상 시험 계획을 동시에 승인받았다.
이후 당국과의 협의에 따라 임상 3상만 진행하기로 결정한 뒤 2018년 10월부터 임상 3상을 진행하고 있다. 셀트리온 관계자는 "지난해 말 중국에서 예상보다 이르게 환자 모집이 완료되는 등 순조롭게 진행 중"이라며 "향후 트룩시마, 허쥬마 등도 순차적으로 진행할 예정"이라고 말했다.
대웅제약도 지난달 보툴리눔 톡신 제제 '나보타'의 중국 임상 3상을 본격화했다. 대웅제약은 중국에서 정식으로 허가받은 보툴리눔 톡신 제제가 2개뿐이라는 점에서 향후 성장 가능성이 높다고 보고 있다.
바이오벤처의 초기 임상 시험도 잇따르고 있다. 브릿지바이오테라퓨틱스는NMPA로부터 궤양성 대장염 신약 후보물질 BBT-401의 임상 1상 시험을 승인받았다. 임상은 오는 5월 개시한다.
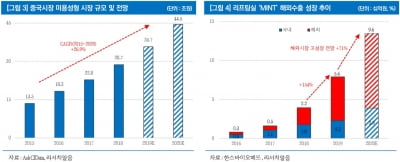
국내 기업의 중국 임상 러시는 중국 의약품 시장의 가파른 성장세와 관련이 있다. 한국바이오협회는 '2011~2020 중국 의약시장 규모' 보고서에서 중국 의약품 시장규모가 2015년 207조5190억원에서 2020년 304조6230억원까지 커질 것이라고 내다봤다.
박상익 기자 dirn@hankyung.com