코로나19 백신 개발의 열쇠, 'DNA 복사본' RNA가 쥐고 있다
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
코로나19 이루는 RNA바이러스
불안정한 구조 탓에 수시로 변형
RNA 변형 과정 규명돼야
코로나19 치료제 개발 길 열려
불안정한 구조 탓에 수시로 변형
RNA 변형 과정 규명돼야
코로나19 치료제 개발 길 열려

DNA→RNA→단백질
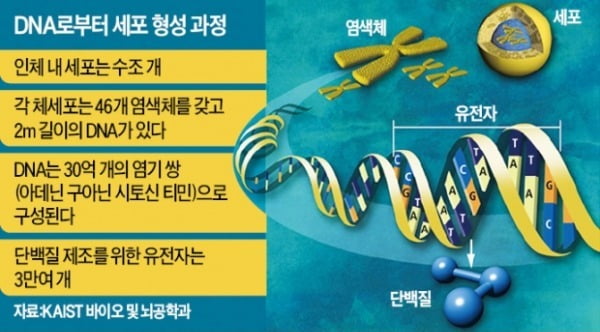
생명현상에 대한 모든 정보는 DNA에 담겨 다음 세대로 전달된다. DNA는 아데닌(A) 구아닌(G) 시토신(C) 티민(T) 등 네 가지 염기의 쌍(A-G 등)이 약 30억 개로 꼬인 이중나선 모양으로 돼 있다. RNA는 DNA(원본)의 유전정보를 옮겨 적은 사본이다. 아데닌 구아닌 시토신 우라실로 이뤄져 있다. DNA와 달리 단일 가닥이다. DNA에서 RNA를 거쳐 단백질이 생성된다.
RNA는 필요에 따라 수시로 생기고 없어진다. 병든 세포를 재생하는 역할도 담당한다. 즉 유전정보 원본을 보존하고 삶을 계속 유지할 수 있게 도와주는 독특한 생명 단위다.
DNA는 사본(RNA)을 형성하기 전 단백질을 구성하는 코드를 지닌 일종의 ‘형틀’을 만든다. 이를 메신저RNA(mRNA)라고 한다. 메신저RNA를 만드는 과정을 ‘전사’, 메신저RNA로부터 단백질을 만드는 것을 ‘번역(translation)’이라 부른다. 메신저RNA의 염기서열을 단백질의 아미노산 배열로 고쳐쓰기 때문에 이런 이름이 붙었다. 얼굴, 신체, 면역력 등이 인간마다 다르고 이것이 후대로 유전되는 것은 RNA 전사·번역과 밀접한 연관이 있다.
그런데 전사와 번역 과정에서 오류가 생겨 ‘이상한 RNA’가 나올 수 있다. 이런 정보전달 왜곡을 막기 위한 ‘품질관리 시스템’이 체내에 존재한다. 공장 불량품 검수 시스템을 연상하면 된다. 이를 난센스 유도 메신저RNA 분해(NMD)라고 한다. NMD시스템에서는 UPF-1 등 일명 ‘품질관리 단백질’이 불량품 RNA를 없앤다.
코로나바이러스는 숙주(인간) 입장에서 보면 이상한 RNA다. 미국 텍사스대 의대 미생물·면역학과 연구진이 2018년 10월 미 국립과학원회보(PNAS)에 실은 논문엔 NMD 시스템 강화로 코로나를 이겨낼 수 있는 단서가 담겨 있다.
이 논문에 따르면 코로나바이러스는 체내 진입 순간 상당량의 메신저RNA를 만들어내 인체 세포와의 접속을 시도한다. 자기증식 과정이다. 이 접속이 성공적으로 이뤄지면 감염이 되는데, 얼마나 어떻게 접속되느냐에 따라 증상의 정도와 경중이 달라진다.
이상한 RNA를 잡아 죽이는 NMD 시스템이 잘 작동하면 무증상이거나 가볍게 앓고 넘어갈 수 있다는 뜻이다. 단 코로나도 NMD에 호락호락 당하고 있지는 않는다. 텍사스대 의대 연구팀은 NMD가 작동할 때 코로나가 ‘N프로테인’이란 단백질을 발현해 NMD 무력화를 시도한다는 사실을 밝혀냈다. NMD는 N프로테인이 충분히 쌓이기 전까지는 싸움을 계속하다가 특정 시점에 급격히 무너지는 것으로 확인됐다. 이 연구는 텍사스대 의대 일본인 학자들이 주도했다.
‘독한 놈’ 코로나바이러스
한국화학연구원 한국과학기술정보연구원 등 정부출연연구소, 고려대, 레고켐바이오사이언스 등 산·학·연이 참여하는 신종바이러스융합연구단은 기존에 알려진 사스 중화항체 두 개와 메르스 중화항체 한 개가 코로나19의 스파이크단백질에 결합할 가능성이 있다는 연구 결과를 내놨다. 스파이크단백질은 코로나바이러스가 세포 내로 침입할 때 활용되는 단백질이다. 앞서 융합연구단은 유전체 분석을 통해 코로나19가 사스 바이러스와 최대 96.3%까지 비슷하다는 사실을 확인했다. 다만 실제로 결합될 수 있을지는 미지수다. 언제라도 RNA 변이를 일으킬 수 있는 바이러스의 특성 때문에 코로나19 결합 부위가 이미 달라져 있다면 기존 항체가 무용지물이 되기 때문이다.
RNA 변형 중 가장 빈번하게 일어나는 ‘N6-메틸아데노신 변형(m6A변형)’도 코로나바이러스 생존에 중요한 역할을 한다. m6A변형은 RNA를 구성하는 ‘아데닌’ 염기에 메틸기가 붙은 형태다. 이 변형을 억제할 수 있다면 RNA바이러스 치료제 개발로 연결될 수 있다는 뜻이다. 이는 미 스탠퍼드대 의대 연구진이 2017년 밝혀냈다. 해당 연구진은 “수백 개의 RNA 변이가 여전히 오리무중”이라며 “m6A변형 연구가 새로운 항바이러스제 개발 단서를 제공할 것”이라고 밝혔다.
국내에서는 김윤기 고려대 생명과학부 교수가 m6A변형이 YTHDF2라는 단백질에 의해 인식되고, 이 단백질이 해당 RNA를 빠르게 제거한다는 사실을 지난해 밝혔다. 김 교수는 “m6A변형은 급성 골수성 백혈병, 간암, 유방암 등 각종 암뿐 아니라 에이즈, 인플루엔자 등 바이러스성 면역 질환에도 관여하지만 구체적인 분자수준 메커니즘은 거의 알려진 바가 없다”며 “바이러스 치료제를 개발하기 위해서는 RNA 변형에 대한 심층 연구가 필요하다”고 말했다.
■ RNA
리보핵산. 데옥시리보핵산(DNA)의 유전정보를 옮겨 적은 ‘복사본’이다. 이중나선 구조로 꼬여 있는 DNA와 달리 단일 가닥으로 돼 있다. 구조가 안정적인 DNA와 달리 불안정해 변형이 쉽게 일어난다. 병든 세포를 치유하거나 생명 현상을 조절하는 역할도 한다. DNA는 필요할 때마다 RNA를 만들고, 이를 형틀로 삼아 아미노산을 조합해 다양한 단백질을 형성한다.
이해성 기자 ihs@hankyung.com



![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


