엔케이맥스, 美임상종양학회서 '슈퍼NK' 임상 중간결과 발표…"9명 중 4명 암세포 감소"
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
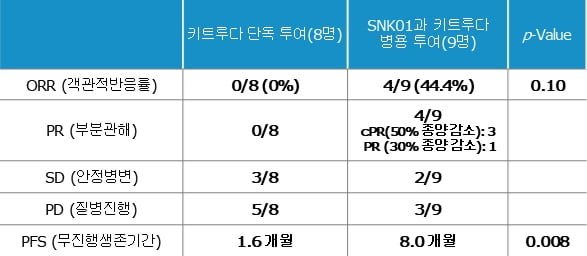
이 임상은 SNK-01과 MSD의 면역관문억제제 키트루다를 병용했을 때 용량별 안전성과 효능을 확인하기 위해 진행됐다. 1차 치료인 화학요법에서 효과를 보지 못한 비소세포폐암 4기 환자 가운데 면역관문 'PD-L1' 발현율이 1% 이상인 20명이 참가했다.
SNK-01의 안전성은 입증됐다. 발표에 따르면 SNK-01과 키트루다를 함께 맞은 실험군 9명 중 SNK-01로 인한 부작용은 나타나지 않았다. 환자 한 명에서 키트루다로 발생한 뇌수막염이 확인됐다. 반면 키트루다만 맞은 8명의 대조군 중 세 명에서는 관절통, 근육통, 흉수 등이 생겼다. 엔케이맥스 관계자는 "NK세포는 면역 반응의 균형을 유지해준다는 연구 결과가 다수 나와 있다"며 "SNK-01이 키트루다의 안전성을 더 개선한다고 보고 있다"고 설명했다.
SNK-01의 병용 치료제 잠재력을 확인한 결과도 나왔다. 실험군 9명 중 4명의 암세포가 줄어들었다. 객관적 반응률(ORR)은 44.4%다. 암세포가 50% 이상 줄어든 환자가 세 명, 30% 이상 감소한 환자가 한 명이었다. 키트루다만 맞은 대조군에서는 암세포가 줄어든 환자가 한 명도 없었다.
엔케이맥스 관계자는 "MSD가 PD-L1 발현율 1% 이상인 폐암 환자를 대상으로 진행한 키트루다 단독 임상에서 ORR은 18%였다"며 "SNK-01 병용 시 치료 효과가 높아지는 게 확인됐다"고 했다.
병이 심해지지 않고 유지되는 기간인 무진행생존기간(PFS) 중간값은 실험군이 8개월, 대조군이 1.6개월로 상당한 차이를 보였다. 회사 관계자는 "MSD가 시행한 키트루다 단독 임상에서 PFS 중간값은 4개월 정도"라며 "화학요법에 반응이 없는 말기 환자임을 고려할 때 유의미한 치료 효과"라고 말했다. 박병국 현대차증권 애널리스트는 "PFS 중간값이 8개월이 나왔다는 것은 매우 고무적"이라고 평가했다.
비소세포폐암 4기 환자는 보통 암이 여러 장기로 전이돼 수술이 힘든 경우가 많다. 비소세포폐암 환자의 67%가 PD-L1 발현율이 1% 이상인데 키트루다는 20~30%에만 효과가 있다. 이를 높이기 위해 다수의 키트루다 병용 임상이 활발하게 이뤄지고 있다. 국내 임상 1/2a상은 추적관찰을 1년간 한 뒤 종료된다.
박 애널리스트는 "치료 대안이 없는 말기 환자들에게 SNK-01은 좋은 선택지가 될 것"이라며 "해외시장에서 다른 업체와 경쟁하려면 동종 치료제가 유리할 것으로 보인다"고 했다. 엔케이맥스는 올해 동종 치료제에 대한 특허를 미국에서 등록했다. 올 하반기에 전임상을 시작하고 내년 임상 1상에 들어간다.
임유 기자 freeu@hankyung.com


![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


