식약처, GC녹십자 '코로나19 혈장치료제' 임상 2상 승인
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
1상 시험은 면제…60명 대상으로 실시

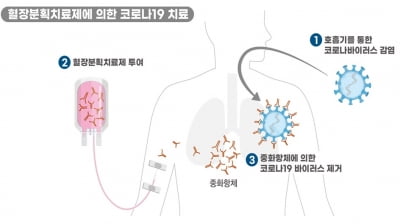
GC5131은 코로나19 완치자의 혈장을 대량으로 수집한 뒤 여러 공정을 거쳐 코로나19 바이러스를 무력화할 수 있는 중화항체를 농축한 '고면역글로불린'(Hyper-immune Globulin) 성분 의약품이다.
식약처는 GC5131의 원료물질인 혈장이 인체에서 유래하고, 중화항체를 이용해 질병을 치료하는 동일 원리를 적용한 제품이 예전부터 개발돼 사용됐다는 점에서 안전성을 평가하는 임상 1상 시험은 면제했다.
임상 2상 시험에서 GC녹십자는 코로나19 환자 중 영상학적 진단으로 폐렴이 확인됐거나 고령 및 기저질환이 있는 고위험군 환자 60명을 대상으로 안전성과 유효성을 평가할 예정이다.
GC녹십자는 임상시험용 제제를 이미 만들었기에 가까운 시일 내 환자에 투여할 수 있을 것으로 보고 있다. 임상은 삼성서울병원, 서울아산병원, 중앙대병원, 고대안산병원, 충남대병원, 연대 세브란스병원 등 6개 병원에서 시행된다.
이미경 한경닷컴 기자 capital@hankyung.com



![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


