"임리직보다 효능 3배 뛰어난 항암바이러스 신약 내놓을 것"
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
권희충 젠셀메드 대표
28년 바이러스 연구끝에 창업
헤르페스바이러스로 암 치료
어댑터·사이토카인 추가 적용
임리직의 단점 개선하고 효능↑
암세포 내에서 복제능력 뛰어나
28년 바이러스 연구끝에 창업
헤르페스바이러스로 암 치료
어댑터·사이토카인 추가 적용
임리직의 단점 개선하고 효능↑
암세포 내에서 복제능력 뛰어나

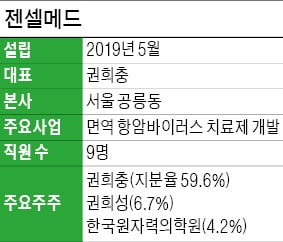
권희충 젠셀메드 대표(59)가 늦깎이 창업에 나선 배경이다. 한국원자력의학원 신약개발 1호 벤처기업으로 지난해 5월 설립된 이 회사는 항암바이러스 치료제를 개발하고 있다. 신라젠 등 기존 항암바이러스 신약 개발 업체들과는 차별화된 기술을 확보하고 있다는 점이 부각되며 최근 국내 투자업계의 비상한 관심을 받고 있다.
바이러스 연구만 28년
그는 5년 만에 귀국했다. 정부 주도로 국내에서 유전자 치료요법 기반 암정복 프로젝트가 처음 시도되던 때다. 당시 원자력병원에 있던 김창민 실장에게서 연락이 왔다. 유전자 연구를 같이해보자고 제의했다. 암정복 프로젝트에는 쟁쟁한 연구자들이 참여했다. 허대석 서울대 교수, 김주항 연세대 교수, 이제호 성균관대 교수 등이 주축 멤버였다. 그는 원자력병원 암연구부에 근무하며 레트로바이러스와 아데노바이러스를 주로 연구했다.
권 대표는 2000년 모교에서 박사학위를 받았다. 바이러스 치료 연구를 시작하고 8년이 지나서였다. 2001년부터 3년 동안 피츠버그의대에서 박사후연구원을 지냈다. 이곳에서 헤르페스바이러스 연구를 시작했다. 바이러스 자체에 대한 연구에 집중하던 그가 치료제 연구에 관심을 두게 된 계기였다. 그는 “헤르페스바이러스를 다루면서 사업 기반 연구에 눈을 떴다”며 “이때부터 암을 치료하는 바이러스 연구에 집중했다”고 했다.
헤르페스에서 신약 가능성 찾다
헤르페스는 우리 몸에 있는 바이러스 가운데 하나다. 주로 신경세포에 숨어서 30~50년 가까이 산다. 몸이 피곤해져 면역력이 떨어지면 입 주위에 물집이 생기는데 이는 헤르페스바이러스 때문이다. 이 바이러스의 변종이 키스바이러스다. 그는 “헤르페스바이러스는 몸속에 있으면서도 치명적인 질환을 일으키지는 않는다”며 “안전성이 입증된 만큼 유전자 치료제로 개발하기에 최적의 조건을 갖추고 있다”고 했다.연구에서도 이런 사실이 확인됐다. 미국 성인 47%에서 헤르페스바이러스 중화항체(HSV-1)가 혈액에 있는 것으로 조사됐다. 성인 절반이 헤르페스바이러스에 안전하다는 의미다.
항암바이러스는 초기엔 헤르페스바이러스를 비롯해 아데노바이러스, 백시니아바이러스, 레오바이러스 등의 야생형 바이러스가 주로 활용됐다. 기대만큼 효과를 내지 못했다. 항암바이러스 연구에 돌파구가 생긴 것은 1991년 유전자재조합으로 만든 헤르페스바이러스인 HSV-1이 나오면서다. 다국적 제약사 암젠은 이 기술을 토대로 2015년 FDA로부터 임리직 판매 허가를 받았다. 세계 최초의 면역 항암바이러스 치료제다.
권 대표는 임리직이 나오기 오래전부터 헤르페스바이러스 관련 연구성과를 해외 유명 학술지에 실었다. 2006년 저널오브바이롤로지, 2011년 몰레큘러테라피, 2012년 바이롤로지 저널 등 바이러스 세포 치료제 분야 학술지에 꾸준히 논문을 게재했다.
치열한 항암바이러스 개발 경쟁
항암바이러스 치료제 시장 전망은 밝다. 1회 투여 가격이 6000만원인 임리직 매출은 2017년 545억원에서 올해 1877억원으로 늘어날 전망이다. 면역관문억제제 키트루다와 병용 임상에서 치료 효과가 2배 이상 높아지는 것으로 나타나 단독요법뿐 아니라 병용요법 치료제로도 주목받고 있다.이 때문에 항암바이러스 치료제 개발 경쟁이 뜨겁다. 미국 MSD는 콕사키바이러스 기반 항암제 카바탁의 임상 2상을 마쳤고 캐나다 온콜리틱스바이오텍은 리오바이러스 기반의 펠라레오렙을 임상 2상 중이다. 일본 다카라바이오는 헤르페스바이러스 기반 항암제인 카네르파추레브의 임상 2상을 하고 있다. 미국 캔들테라퓨틱스는 전립선암 치료제로 아데노바이러스 기반 항암제의 임상 3상을 하고 있다.
클리니컬트라이얼에 따르면 지난 8월 말 기준 세계적으로 진행 중인 항암바이러스 임상은 42건이다. 아데노바이러스가 18건(42.9%)으로 가장 많다. 헤르페스바이러스가 8건, 백시니아바이러스 6건, 레트로바이러스 5건 등이다. 권 대표는 “아데노바이러스 기반 항암바이러스 치료제 1~2개가 머잖아 FDA 승인을 받을 가능성이 높다”며 “항암바이러스 시장이 빠르게 커질 것”이라고 했다.
2세대 항암바이러스 개발
헤르페스바이러스 기반 1세대 항암바이러스 치료제인 임리직의 단점은 크게 세 가지가 꼽힌다. 첫째는 암세포 내에서 복제 능력이 현저히 떨어진다는 점이다. 헤르페스바이러스 복제에 관여하는 ‘34.5’ 유전자를 제거한 탓이다. 정상세포에 독성을 일으킬 수 있어 34.5 유전자가 불활성화되도록 했는데 이 영향으로 복제 능력이 100배 정도 낮아졌다. 둘째는 제한적인 항암 효과다. 임리직은 라스 유전자가 발현되는 암에만 효과가 있다. 라스 유전자는 암세포의 35%에서만 발현되는 것으로 알려져 있다. 셋째는 투약 방식이다. 임리직은 암세포 부위에 직접 주사해야 효과를 낸다. 피부암처럼 식별이 용이한 암이 아니면 사용이 제한적이라는 의미다.젠셀메드가 개발 중인 면역 항암제는 2세대 항암바이러스 치료 기술이다. 임리직에는 없는 어댑터와 사이토카인을 추가로 적용해 효능을 크게 높였다. 재조합단백질인 어댑터는 일종의 플랫폼 기술이다. Her2, CEA 등 암세포에 발현되는 40여 종의 종양표지자를 타깃할 수 있다. 권 대표는 “4개의 종양표지자를 대상으로 실험하고 있다”고 했다.
어댑터는 최근 항암바이러스 치료제에 쓰이는 기술이다. 암젠도 어댑터를 활용한 CAR-T 치료제 임상 1상을 하고 있다. 젠셀메드 기술의 강점은 크게 세 가지다. 첫째는 암세포에만 헤르페스바이러스가 들어가도록 하는 어댑터 기술이다. 어댑터 한쪽은 바이러스에 달라붙는 수용체(HveA), 다른 한쪽은 암 항원에 붙는 항체(ScFv)로 이뤄져 있다. 헤르페스바이러스가 특정 항원이 발현되는 암세포만 찾아들어가게 하기 때문에 정상세포에는 영향을 주지 않는다.
둘째 복제 능력이 뛰어나다. 암세포만 타깃하는 어댑터 기술 덕분에 헤르페스바이러스 복제에 관여하는 34.5 유전자를 불활성화할 필요가 없어서다. 권 대표는 “헤르페스바이러스가 암세포에 들어간 뒤 정상세포가 복제되는 수준으로 복제가 이뤄진다”며 “임리직보다 효과가 3배 이상 뛰어나다”고 했다.
셋째는 바이러스 하나에 3~4개의 유전자를 동시에 넣을 수 있는 기술이다. Her2, EGRF, CEA, EpCAM 등 타깃하는 종양표지자와 면역세포인 T세포를 활성화해주는 사이토카인을 동시에 집어넣어 항암 효과를 극대화할 수 있다. 사이토카인은 인터류킨(IL)-7, IL-12 등 두 가지다. IL-7은 T세포 활성이 유지되도록 돕고, IL-12는 T세포가 활성화되도록 하는 역할을 한다. 한쪽에서는 암세포의 면역관문을 겨냥하고 다른 한쪽에서는 암세포를 공격하는 T세포를 활성화하는 두 가지 기전을 동시에 발휘한다. 권 대표는 “바이러스에 여러 개 유전자를 동시에 넣는 기술을 가진 경쟁사는 아직 없다”고 했다.
“내년 전임상 계획”
젠셀메드는 유방암 난소암 위암 등 Her2가 과발현되는 암종과 뇌암 췌장암 등의 파이프라인을 갖추고 있다. Her2 발현 고형암 파이프라인은 내년 전임상(동물실험)을 시작하고 2023년께 FDA에 임상 1상 계획승인 신청을 할 예정이다. 계획대로라면 2024년께 임상 1상에 들어갈 수 있다. 권 대표는 “국내에는 항암바이러스 시약을 제조할 위탁생산업체(CMO)가 없어 미국에서 임상을 하려고 한다”며 “연구 과정에서 성과에 따라 뇌암 또는 췌장암 파이프라인을 먼저 개발할 수도 있다”고 했다.젠셀메드는 임상 2상에 들어가는 4~5년 뒤 상장에 나설 계획이다. 권 대표는 “글로벌 임상은 많은 비용이 들기 때문에 다국적 제약사에 기술이전도 적극 추진하겠다”고 말했다.
박영태 기자 pyt@hankyung.com



![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


