브릿지바이오 "궤양성대장염 신약, 내년 기술수출 모색할 것"
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
일부 환자에서 병변 약물 전달 확인
제형 달리해 약물기전 증명 시험 별도 진행
제형 달리해 약물기전 증명 시험 별도 진행
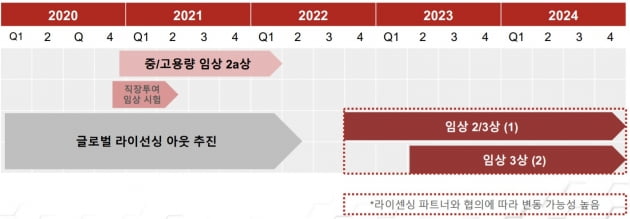
미국에서 활동성 궤양성 대장염 환자들을 대상으로 진행한 탐색적 임상 2a상의 저용량군 시험을 통해, 다음 단계인 중용량 및 고용량군 시험 진입에 대한 충분한 근거를 확보했다는 설명이다. 이에 따라 계획대로 임상 개발을 추진해 나갈 계획이다.
미국에서 16명의 경증 및 중증 궤양성 대장염 환자를 대상으로 진행한 임상 2a상의 저용량군 시험에서는 BBT-401의 안전성과 유효성이 검증됐다. 궤양성 대장염 치료 신약 시장에서 대표적인 경쟁 약물로 꼽히는 'TD-1473'과 유사한 수준의 약효 결과를 확인했다.
브릿지바이오는 이번 설명회에서 대장까지 약물을 전달하는 제형 개선 연구와 관련한 주요 내용도 전했다. 대장의 말단인 직장부터 시작해 염증 부위가 점점 확산돼가는 궤양성 대장염의 특성상, 약물이 환부까지 전달되도록 하는 제형 개발도 매우 중요한 요소라는 것이다. 회사는 인체의 소화기관 구조를 실험실에서 구현한 'SHIME'(The Simulator of the Human Intestinal Microbial Ecosystem)을 활용해서 기존 제형 대비 신규 제형의 약물 전달 개선 정도를 비교했다.
실험 결과, 대장 내 전달이 1% 이하였던 기존 제형 대비 개선된 제형은 투여 약물의 80% 이상이 소장 말단 및 대장 초입까지 전달됐다. 투여량 중 9.4%(식사 후 조건 기준) 혹은 27.4%(공복 기준)가 대장 말단까지 전달되는 것도 확인했다.
브릿지바이오는 개선 전 제형을 사용한 저용량군 임상 결과에서는 일부 환자에서만 환부에서 약물이 검출된 점을 감안하면, 개선된 제형과 용량이 증가된 시험군에서 나올 효력 결과를 더욱 기대하고 있다. 중·고용량 시험과 더불어 투약 방식을 새롭게 한 보충 시험을 동시에 추진, 신약개발 속도를 높일 방침이다.
연말에서 내년 초 진입이 예상되는 임상 2a상의 중용량 및 고용량 시험은 기존 임상 국가인 미국과 더불어 한국 뉴질랜드 폴란드 우크라이나 등 더 다양한 국가에서 총 40여개의 임상기관으로 확대해 진행할 예정이다. 중용량군과 고용량군, 위약군 환자 각각 12명을 배정해 중등도 및 중증 궤양성 대장염 환자에서의 약물에 대한 임상 반응 효력을 탐색하게 된다.
또 병변인 직장을 통해 약물을 직접적으로 주입하는 방식의 약물기전 증명을 위한 보충 시험은 연내 뉴질랜드에서 시작될 것으로 보고 있다. 보충 시험을 통해 병변에 직접적으로 약물을 투여했을 경우의 안전성 및 효능을 살피게 된다. 경구 형태가 아닌 직장 투여 경로의 제형을 개발하기 위한 탐색 작업이다.
이정규 브릿지바이오 대표는 "BBT-401 임상 2a상의 중·고용량 시험을 순조롭게 진행해, 내년에는 최적의 글로벌 제약사와 협력을 모색하겠다"고 말했다.
차세대 표적항암제 'BBT-176'은 연말이나 내년 초 국내 임상 참여 환자를 우선적으로 모집할 계획이다.
한민수 기자 hms@hankyung.com


![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


