삼성바이오에피스, 루센티스 바이오시밀러 美 허가심사 착수
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
FDA, SB11 품목허가 심사 개시
유럽은 지난달 심사 착수
유럽은 지난달 심사 착수

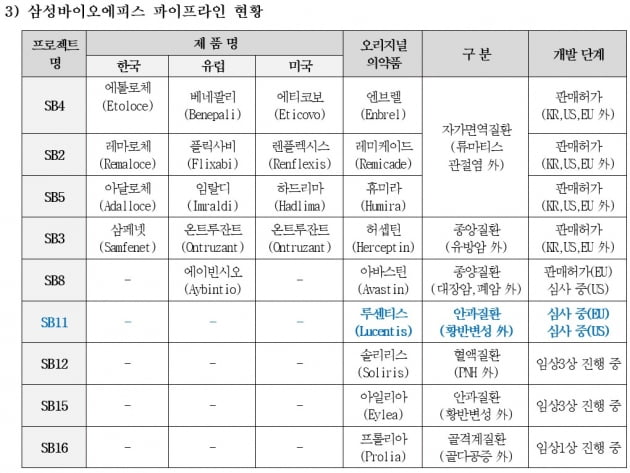
미국 식품의약국(FDA)은 삼성바이오에피스가 지난 9월 제출한 SB11의 바이오의약품 품목허가 신청서(BLA)에 대한 사전 검토를 완료했다. 본격적인 서류 심사에 들어갔다.
SB11은 다국적 제약사 로슈와 노바티스가 판매 중인 황반변성, 당뇨병성 황반부종 등 안과질환 치료제 루센티스의 바이오시밀러(바이오의약품 복제약)이다. 루센티스의 연간 매출은 작년 기준 약 4조6000억원에 달하며, 미국 시장이 절반 가량을 차지한다.
삼성바이오에피스는 최근 비대면으로 개최된 미국 안과학회(AAO) 연례 학술대회를 통해 SB11의 글로벌 임상 3상 최종 결과를 발표했다. 총 705명의 습성(신생혈관성) 연령 유관 황반변성(nAMD) 환자 대상 임상시험의 52주 결과 분석을 통해, SB11과 루센티스 간의 임상의학적 동등성을 확인했다.
삼성바이오에피스는 현재 미국에서 자가면역질환 치료제 렌플렉시스(레미케이드 바이오시밀러, 성분명 인플릭시맵)와 항암제
온트루잔트(허셉틴 바이오시밀러)를 판매하고 있다. 이밖에 에티코보(엔브렐 바이오시밀러), 하드리마(휴미라 바이오시밀러)의 판매허가를 획득했다. 'SB8'(아바스틴 바이오시밀러)은 지난해 11월부터 판매허가 심사 중에 있다.
SB11은 삼성바이오에피스가 선보이는 여섯번째 바이오시밀러다. 지난달 유럽에 이어 이달 미국에서 판매허가 심사가 개시됐다. 삼성바이오에피스가 개발 중인 안과질환 치료제는 SB11 외에도 'SB15'(아일리아 바이오시밀러)가 있다. 삼성바이오에피스는 미국 바이오젠과의 협력 계약을 통해 두 제품의 세계 시장 영업망을 구축 중이다.




![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


