9일 지노믹트리에 따르면 회사는 신규 바이오마커(생체표지자) ‘mePCDHGA12’를 발굴하고, 이에 기반한 폐암 진단키트를 개발하고 있다. 2017년 식약처의 임상시험계획(IND) 승인을 받아 임상에서 민감도(양성 확인율) 77.8%, 특이도(음성 확인율) 92.3%의 성능을 확인했다.
회사는 임상 결과를 바탕으로 지난 3월 식약처에 얼리텍 폐암 제품에 대한 제조 허가를 신청했다. 이후 두 번의 보완절차와 한 번의 체외진단의료기기 전문가위원회를 통한 질의응답을 거쳐 지난 7일 최종 제조허가 신청이 반려됐음을 통보받았다.
식약처는 제조허가 신청을 반려한 근거로 통계적 분석 과정 중 근거가 부족하다고 지적했다. 비소세포폐암의 병기별 세부 분석 중 1·2기에 대한 민감도가 70%에 미치지 못 한다는 점, 남성 대비 여성에서 민감도가 낮은 점, 40대 환자의 등록률이 낮고 민감도가 33.3%로 미흡한 점 등을 들었다.
이에 대해 회사는 얼리텍 폐암 제품 성능에 대한 문제는 아니라는 입장이다. IND 승인 시 제시했던 성능 목표치를 달성한데다, IND 승인 시에는 성별과 연령대에 따른 세부적인 민감도 목표치도 포함되지 않았다는 것이다.
이에 지노믹트리는 혈액 기반 폐암 분자진단법인 얼리텍 폐암 제품을 개발했다. 얼리텍 폐암은 CT 촬영 후 양성 결절이 나온 환자를 제한적으로 진단하는 데 사용된다.
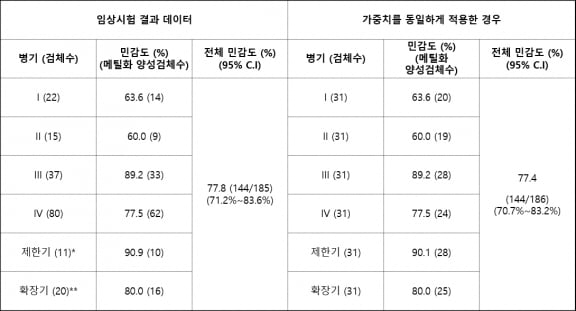
지노믹트리는 칠곡경북대병원에서 얼리텍 폐암에 대한 안전성과 유효성을 평가하는 임상을 수행했다. 임상 결과 전체 민감도 77.8%(폐암 환자 185명), 특이도 93.2% (정상인 50명, 양성 폐결절 환자 202명, 양성폐질환 35명)의 성능을 확인했다.
비소세포암 병기 구분인 ‘1~4기’에 대한 민감도는 각각 1기 63.6%, 2기 60.0%, 3기 89.2%,4기 77.5%로 나타났다. 소세포암의 병기 구분인 제한기와 확장기에 대한 병기별 민감도는 제한기 90.9%, 확장기 80.0%였다.
전체 민감도 목표치를 70% 이상으로 하면 폐암의 6가지 병기에 대한 통계적 유의성을 달성하기 위해서는 전체 민감도가 76.8% 이상이 돼야 한다는 설명이다. 얼리텍 폐암은 병기별 가중치를 동일하게 적용해 통계적 유의성을 재분석했을 때도 전체 민감도가 77.4%로 나타났다.
안성환 지노믹트리 대표는 “당초 병기별 목표치가 아닌 전체 병기에 대한 민감도 목표치를 70%로 제시해 IND를 승인받았다”며 “이 목표치를 통계적으로 유의하게 달성해 제조허가 신청을 한 것”이라고 설명했다.
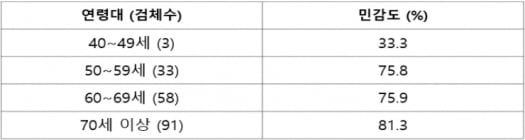
안 대표는 “실제 임상현장에서는 40대 환자의 비율이 상대적으로 매우 낮다”며 “연령대에 대한 세부 사항을 IND 임상시험 계획 당시 논의했다면, 임상에서 40대 결절환자들에 대해 목표치를 달리 했을 것”이라고 말했다.
그는 “바이오마커 기반의 진단 제품은 새로운 지식과 절차를 기반으로 해 여러 과정에서 오해가 있을 수 있다는 점을 인지했다”며 “조만간 식약처로부터 전문가위원회의 평가 내용을 전달 받아 어떤 부분이 미흡했는지를 파악한 후, 제품의 성능이나 임상에 문제가 있는 것이 아님을 적극적으로 어필하고 추후 대응 방향을 고려할 계획”이라고 말했다.
이어 “현재 기관지세척액을 이용한 폐암진단용 제품, 고위험군 대상 폐암선별용 검사 제품 등을 개발하고 있다”며 “이들 제품의 개발과 허가를 위해 바이오마커 기반의 암 진단을 위한 체외진단 의료기기 평가가 합리적으로 진행될 수 있도록 노력하겠다”고 덧붙였다.
김예나 기자 yena@hankyung.com