코로나19 백신·치료제 허가심사 기간 180일→40일
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
식품의약품안전처는 27일 최근 국내외에서 개발 중인 신종 코로나바이러스 감염증(코로나19) 백신 및 치료제의 허가과정을 설명했다.
해외 제약사 아스트라제네카, 얀센(존슨앤드존슨), 화이자의 백신에 대해서는 현재 식약처 사전검토가 진행 중이다.
국내 항체치료제 개발 업체 셀트리온은 이달 중에 사용승인을 신청할 예정이라고 밝힌 바 있다.
의약품 허가 절차는 제조·수입업체가 품목허가를 신청하면 시작된다.
업체는 허가 신청 시 약사법 제31조·제42조에 규정된 허가에 필요한 비임상, 임상, 품질 등의 자료를 식약처 '의약품안전나라'에 제출해야 한다.
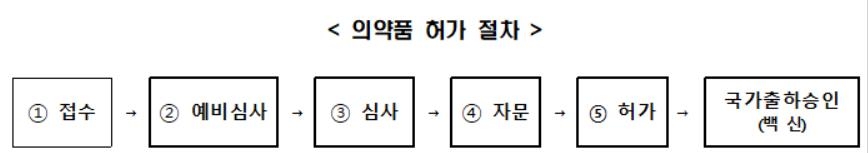
생물학적 제제인 백신은 국가가 한 번 더 품질을 확인하는 국가출하승인을 거쳐야 유통, 판매를 할 수 있다.
코로나19 백신의 경우 통상 2∼3개월 이상인 기존 국가출하승인 처리기간을 단축해 20일 이내에 처리하는 것을 목표로 추진할 계획이다.
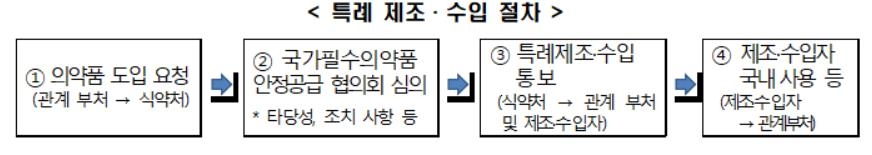
의약품은 품목허가를 받아야 제조 또는 수입할 수 있으나, 약사법 제85조의2에서는 특례 승인 절차를 규정하고 있다.
질병관리청 등 관계부처의 장은 감염병 등에 대처하기 위해 식약처장에게 특례 제조나 수입을 요청할 수 있다.
이를 승인받으면 국내에 품목허가를 받지 않은 의약품을 제조하거나 수입할 수 있다.
이달 25일 기준 현재 화이자 백신은 미국, 영국 등 8개국에서 긴급사용승인을 받았고, 유럽연합과 스위스에서 조건부 허가를 받았다.
모더나 백신은 미국에서 긴급사용승인을 받았다.
국내에서는 현재 5개 제품이 임상 중이며, 대부분 초기 단계인 1상이나 1/2상 단계에 있다.
치료제의 경우 다국적 제약사 릴리, 리제네론에서 항체치료제 임상 3상이 진행 중이며, 미국에서 긴급사용승인을 받았다.
관절염 치료제 성분인 '바리시티닙' 등 기존 의약품에 대해 코로나19 치료 효능을 추가하기 위한 임상도 이뤄지고 있다.
국내에서는 새로운 코로나19 치료제로 개발 중인 항체치료제 등 총 15개 제품(13개 성분)이 임상 중이다.
[표1] 코로나19 백신 임상 시험 진행 현황
┌──┬──────┬────┬──────────────┬──┬────┐
│연번│ 의뢰자 │ 제품명 │ 임상시험 내용(요약) │ 단 │ 승인일 │
│ │ │ │ │ 계 │ │
├──┼──────┼────┼──────────────┼──┼────┤
│ 1 │국제백신연구│INO-4800│건강한 성인 대상 피내 접종 │1/2a│2020-06-│
│ │ 소 │ │후 전기천공법(Electroporatio│ 상 │ 02 │
│ │ │ │n, EP)을 이용하는 코로나19 │ │ │
│ │ │ │백신의 안전성, 내약성 및 면 │ │ │
│ │ │ │역원성 평가 │ │ │
├──┼──────┼────┼──────────────┼──┼────┤
│ 2 │에스케이바이│NBP2001 │건강한 만 19~55세 성인을 대 │1상 │2020-11-│
│ │ 오 │ │상 코로나19 백신의 안전성, │ │ 23 │
│ │사이언스(주)│ │내약성 및 면역원성 평가 │ │ │
├──┼──────┼────┼──────────────┼──┼────┤
│ 3 │ (주)셀리드 │AdCLD-Co│건강한 성인 자원자를 대상 코│1/2a│2020-12-│
│ │ │V19 │로나19 백신의 안전성, 면역원│ 상 │ 04 │
│ │ │ │성 확인 │ │ │
├──┼──────┼────┼──────────────┼──┼────┤
│ 4 │진원생명과학│GLS-5310│건강한 성인에게 피내 접종하 │1/2a│2020-12-│
│ │(주) │ │는 코로나19 백신의 안전성, │ 상 │ 04 │
│ │ │ │내약성 및 면역원성 평가 │ │ │
├──┼──────┼────┼──────────────┼──┼────┤
│ 5 │ (주)제넥신 │ GX-19N │건강한 성인을 대상으로 코로 │1/2a│2020-12-│
│ │ │ │나19 백신의 안전성, 내약성 │ 상 │ 11 │
│ │ │ │및 면역원성 탐색 │ │ │
└──┴──────┴────┴──────────────┴──┴────┘
[표2] 코로나19 치료제 임상 시험 진행 현황
┌──┬──────┬─────┬─────────────┬──┬────┐
│연번│ 의뢰자 │ 제품명 │ 임상시험 내용(요약) │ 단 │ 승인일 │
│ │ │ (성분명) │ │ 계 │ │
├──┼──────┼─────┼─────────────┼──┼────┤
│ 1 │부광약품(주)│ 레보비르 │중등증 코로나19 환자 대상 │2상 │2020-04-│
│ │ │ 캡슐30mg │시판 의약품(B형간염약)의 │ │ 14 │
│ │ │(클레부딘)│안전성·유효성 평가 │ │ │
├──┼──────┼─────┼─────────────┼──┼────┤
│ 2 │ 엔지켐 │ EC-18 │코로나19 폐렴환자 대상 임 │2상 │2020-05-│
│ │ 생명과학 │ │상시험 의약품(호중구감소증│ │ 12 │
│ │ │ │약)의 안전성·유효성 평가 │ │ │
├──┼──────┼─────┼─────────────┼──┼────┤
│ 3 │신풍제약(주)│피라맥스정│경증 또는 중등증 코로나19 │2상 │2020-05-│
│ │ │(피로라리 │환자 대상 시판 의약품(항말│ │ 13 │
│ │ │딘, 알테수│라리아제)의 안전성·유효성│ │ │
│ │ │ 네이트) │ 및 안전성 비교 평가 │ │ │
├──┼──────┼─────┼─────────────┼──┼────┤
│ 4 │ (주)종근당 │ CKD-314 │코로나19 폐렴 입원환자 대 │2상 │2020-06-│
│ │ │(나파모스 │상 시판 의약품(항응고제)의│ │ 17 │
│ │ │ 타트) │ 안전성·유효성 평가 │ │ │
├──┼──────┼─────┼─────────────┼──┼────┤
│ 5 │ 크리스탈 │ CG-CAM20 │코로나19 환자 대상 시판 의│2상 │2020-07-│
│ │지노믹스(주)│(카모스타 │약품(췌장염약)의 안전성· │ │ 01 │
│ │ │ 트) │유효성 평가 │ │ │
├──┼──────┼─────┼─────────────┼──┼────┤
│ 6 │(주)대웅제약│ DW1248정 │경증 및 중등증 코로나19 환│2/3 │2020-07-│
│ │ │(카모스타 │자 대상 시판 의약품(췌장염│ 상 │ 06 │
│ │ │ 트) │약) 안전성·유효성 평가 │ │ │
├──┼──────┼─────┼─────────────┼──┼────┤
│ 7 │ (주)제넥신 │ GX-I7 │코로나19 환자 대상 임상시 │1b상│2020-08-│
│ │ │ │험 의약품(항암제)의 안전성│ │ 07 │
│ │ │ │·예비 효과 탐색 │ │ │
├──┼──────┼─────┼─────────────┼──┼────┤
│ 8 │ (주)녹십자 │ GC5131 │코로나19 환자 대상 H-Ig(고│2상 │2020-08-│
│ │ │ │면역글로불린)의 용량 설정 │ │ 20 │
│ │ │ │및 유효성·안전성 평가 │ │ │
├──┼──────┼─────┼─────────────┼──┼────┤
│ 9 │(주)셀트리온│ CT-P59 │코로나19 경증 환자 대상 안│1상 │2020-08-│
│ │ │ │전성·내약성 및 바이러스학│ │ 25 │
│ │ │ │ 평가 │ │ │
│ │ │ ├─────────────┼──┼────┤
│ │ │ │경증, 중등증 코로나19 환자│2/3 │2020-09-│
│ │ │ │ 대상 표준 치료와 병행하여│ 상 │ 17 │
│ │ │ │ 안전성·유효성 평가 │ │ │
│ │ │ ├─────────────┼──┼────┤
│ │ │ │코로나19 환자 접촉자 대상 │3상 │2020-10-│
│ │ │ │예방적 유효성, 바이러스학 │ │ 08 │
│ │ │ │및 안전성 평가 │ │ │
├──┼──────┼─────┼─────────────┼──┼────┤
│ 10 │ 한국릴리 │LY3009104 │코로나19 환자에 대한 시판 │3상 │2020-09-│
│ │ │(바리시티 │의약품(관절염약)의 치료적 │ │ 07 │
│ │ │닙) │확증 시험 │ │ │
├──┼──────┼─────┼─────────────┼──┼────┤
│ 11 │(주)대웅제약│DWRX2003 │건강한 성인 대상 시판 의약│1상 │2020-10-│
│ │ │(니클로사 │품(구충제)의 안전성·내약 │ │ 08 │
│ │ │미드) │성 및 약동학적 특성 평가 │ │ │
├──┼──────┼─────┼─────────────┼──┼────┤
│ 12 │한국엠에스디│ MK-4482 │코로나19 성인 입원 환자 대│2/3 │2020-10-│
│ │ │ │상 임상시험 의약품(인플루 │ 상 │ 29 │
│ │ │ │엔자약)의 안전성·유효성, │ │ │
│ │ │ │약동학 평가 │ │ │
├──┼──────┼─────┼─────────────┼──┼────┤
│ 13 │ 뉴젠 │뉴젠나파모│건강한 성인 남성 대상 시판│1상 │2020-11-│
│ │ 테라퓨틱스 │스타트정 │ 의약품(항응고제)의 안전성│ │ 03 │
│ │ │(나파모스 │·내약성 및 약동학적 특성 │ │ │
│ │ │타트) │평가 │ │ │
├──┼──────┼─────┼─────────────┼──┼────┤
│ 14 │동화약품(주)│ DW2008S │중등증 코로나19 환자 대상 │2상 │2020-11-│
│ │ │ │임상시험 의약품(천식약)의 │ │ 23 │
│ │ │ │안전성·유효성 비교 평가 │ │ │
├──┼──────┼─────┼─────────────┼──┼────┤
│ 15 │(주)이뮨메드│hzVSF-v13 │코로나19 중등증 및 중증 환│2상 │2020-12-│
│ │ │ │자 대상 임상시험 의약품( │ │ 07 │
│ │ │ │인플루엔자약)의 표준 요법 │ │ │
│ │ │ │과 각 용량 별 hzVSF-v13 병│ │ │
│ │ │ │용투여 시 안전성·유효성 │ │ │
│ │ │ │및 안전성을 단독 표준 요법│ │ │
│ │ │ │군과 비교 평가 │ │ │
└──┴──────┴─────┴─────────────┴──┴────┘
※ 식품의약품안전처 제공. 재판매 및 DB 금지
/연합뉴스
-
기사 스크랩
-
공유
-
프린트


![[단독] 우리금융, 동양·ABL생명 함께 품는다](https://timg.hankyung.com/t/560x0/data/service/edit_img/202406/4bd37d860d109c324069e5663a99d843.jpg)

![강달러에 주춤한 금값…"기관이 사면 30% 오를 것" 전망도 [원자재 포커스]](https://timg.hankyung.com/t/560x0/photo/202406/01.37168235.1.jpg)

![[단독] 반도체 실탄 확보 나선 삼성·하이닉스…"AI칩 전쟁서 승리할 것"](https://timg.hankyung.com/t/560x0/photo/202406/AA.37161891.3.jpg)

![[단독] 1%만 쓰는 폰…'영상통화 시대' 이끈 3G 막 내린다](https://timg.hankyung.com/t/560x0/photo/202406/AA.37161743.3.jpg)




