약물 개발 배경
글로벌 시장조사기관 글로벌데이터의 보고서에 따르면 미국, 유럽 5개국, 일본 등 세계 주요 7개국의 궤양성 대장염 시장은 2016년 기준 53억 달러에서 2026년 68억 달러까지 성장할 것으로 전망된다. 제품군 별로 살펴보면, 현재 다른 치료 옵션이 없는 1차 치료제 5-ASA가 20% 수준의 시장을 지속적으로 유지하는 것으로 보고 있다. 또 3차 치료제인 항 TNF제제는 2016년 전체 시장의 절반을 차지하고 있으나, 지속적인 경쟁약물의 개발과 바이오시밀러의 개발로 2026년 시장점유율이 30% 초반대로 감소할 것으로 예측되고 있다.
현재 궤양성 대장염 치료제 시장에서는 1차 치료제인 메살라민(5-ASA) 계열 의약품은 1930년대 나온 전통적인 치료제다. 오랫동안 쓰인 약이다 보니 안전성이 보장돼 있고 가격이 낮다는 장점이 있지만 효능에서 아쉬운 부분이 있었다. 메살라민으로 치료가 되지 못하고 증상이 악화될 경우에는 스테로이드 제제를 2차 약제로 사용하는데, 오래 복용할 시 부작용이 크기 때문에 근본적 해결이 어렵다. 이런 배경에서 개발된 항체의약품은 효능은 뛰어나지만 약가가 비싸다는 단점때문에 이를 대체할 1차 치료제의 개발이 필요한 실정이다.
2015년 10월 한국화학연구원과 성균관대로부터 전세계 독점실시권을 넘겨받아 BBT-401을 개발 중에 있다. BBT-401은 염증신호전달 상에서 단백질 간 상호작용에 중요한 역할을 하는 펠리노-1(Pellino-1)이라는 단백질의 기능을 차단하는 물질이다. BBT-401은 경구 투여 시 전신 흡수가 되지 않고 위장관 내에서만 작용하는 것이 가장 큰 특징이다. 현재 궤양성 대장염 치료제 시장에서 BBT-401과 같이 펠리노-1의 기능을 저해하는 기전의 약물이 상업화된 적이 없어 개발이 완료되면 계열 내 최초 의약품(first-in-class)이 될 것으로 기대된다.
작용기전
BBT-401은 펠리노-1 단백질을 차단하는 펩타이드를 이용한 궤양성 대장염 치료제 후보물질이다. 연구는 박석희 성균관대 교수팀이 시작했다. 펠리노-1을 발굴하고 검증해 온 미국의 MD앤더슨암센터의 사오 콩 선 교수팀의 장미경 박사(현 브릿지바이오테라퓨틱스 미국 자회사 소속)와 펠리노-1의 억제 기전 연구를 통해 BBT-401의 모체가 된 ‘스매듀신-6’(Smaducin-6·펠리노-1의 활성 저해 연구 물질)를 개발했다.
이후 스매듀신-6의 전체 아미노산 중 펠리노-1과 특이적 결합을 하는 최적 부위를 도출했다. 최종적으로 염증반응을 억제할 수 있는 신약 후보물질인 BBT-401을 발굴하는 과정에서 이광호 한국화학연구원 박사팀과 성균관대 연구팀이 공동 연구를 수행했다.
펠리노-1 단백질은 1999년 면역반응에 관여하는 물질로 발견됐다. 3개의 패밀리(펠리노-1, 펠리노-2, 펠리노-3) 가운데 BBT-401의 표적 단백질인 펠리노-1은 세포막 표면 아래 존재하며 세포내 여러 신호 전달 기전에 관여하고 있다.
이런 신호 전달 기전들 가운데 TLR-4(Toll-like receptor 4·톨유사수용체 4) 혹은 IL-1(Interleukin-1·인터루킨 1)에 의한 염증반응에서 Smad-6가 펠리노-1에 직접 결합해 MyD88·IRAK1 복합체의 형성을 저해하는 것이 밝혀졌다. 이런 복합체가 형성되지 않으면 결과적으로 염증신호복합체가 형성이 되지 않아 세포내 염증 신호는 차단되고 더 나아가 항염증 효과를 보일 수 있다는 것이 추가로 밝혀졌다.
초기 과학연구를 진행한 성균관대 연구팀에서는 Smad-6의 전체 아미노산 서열 가운데, 펠리노-1과 결합하는 최소 부위를 찾아내는 과정에서 아미노산 20개짜리 펩타이드인 중간 단계 물질 ‘스매듀신-6(Smaducin-6)’를 도출했다. 성균관대와 한국화학연구원 공동연구팀은 경구투여가 가능하도록 분자량이 작으면서도 이와 같은 항염증 효과를 나타내는 BBT-401을 발굴하게 됐다.
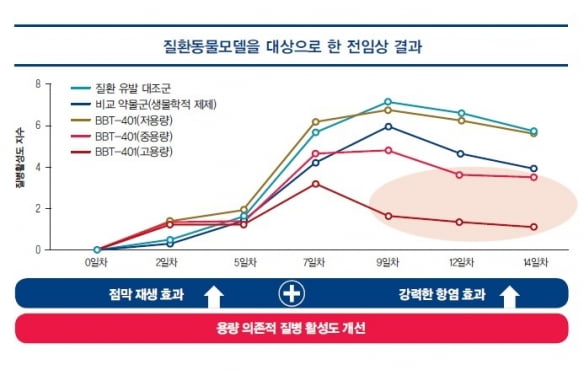
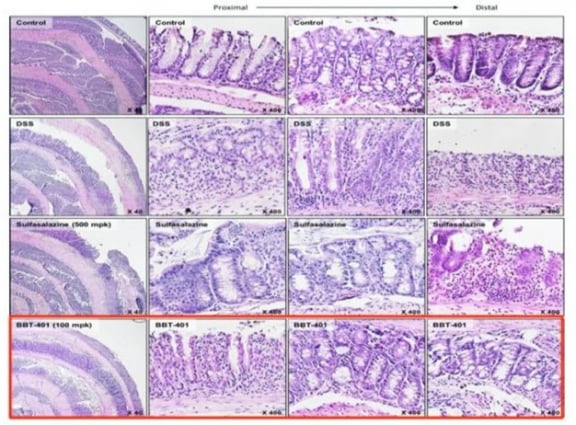
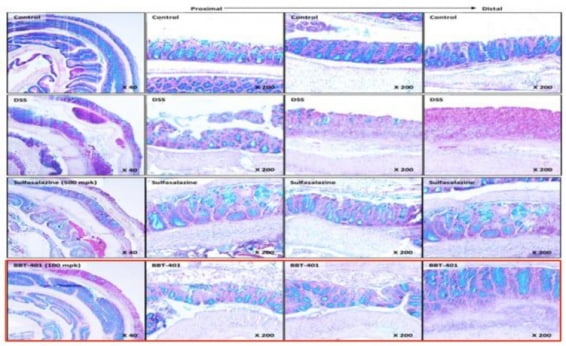
브릿지바이오테라퓨틱스는 성균관대와 한국화학연구원으로부터 해당 후보물질을 2015년 10월 도입해 현재까지 임상 개발을 이끌어가고 있다. BBT-401 관련 질환 동물 모델에서 우수한 항염증 및 대장 점막 재생 효과를 입증했고, GLP 독성시험에서도 우수한 안전성을 확인했다.
이런 전임상 결과를 바탕으로 2018년 2월 미국 식품의약국(FDA)으로부터 임상 진행 승인을 받아 미국에서 임상 1상을 진행한 결과, BBT-401의 약리 효과 및 안전성에 대해 확인할 수 있었다.
임상 1상 마무리 이후 실제 환자군을 대상으로 한 임상 2상에 진입했다. 현재 미국에서 임상 2a상을 진행하고 있으며, 해당 임상의 첫번째 용량군 진행 이후 중·고용량 시험은 미국, 한국, 뉴질랜드, 동유럽 국가(폴란드, 우크라이나)에서 다국가 임상으로 확대 진행될 예정이다. 향후 약물 투여 방식을 달리한 추가 제형 탐색을 위한 시험 등이 추가로 진행 될 예정이다.
BBT-401은 세계 최초의 펠리노-1 저해제이다. 전세계에서 가장 앞서 펠리노-1의 억제 기전에 대한 연구 개발 결과를 확립해 나가고 있다. 펠리노-1은 아직 많은 부분이 미지의 영역인 세포내 신호 전달 조절 물질로, 많은 연구자들에 의해 기전 연구가 지속적으로 진행되고 있다. 이에 따라 새로운 적응증의 응용은 매우 광범위하게 열려 있는 것으로 예상된다. 현재 주력으로 우선 개발 중인 궤양성 대장염뿐 아니라 다양한 질환 치료제로서의 개발을 탐색하고 있다.
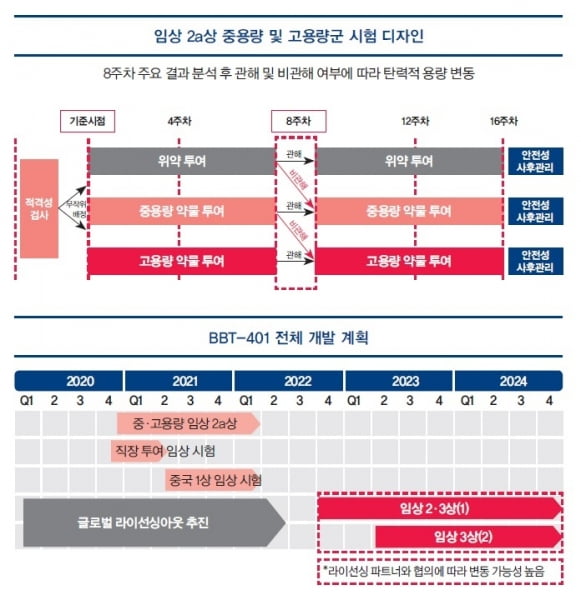
궤양성 대장염 환자를 대상으로 하는 임상 2a상의 중용량 및 고용량군 시험을 다국가 임상으로 올초 시작해 올해 말 또는 내년 초 종료하는 게 목표다. 2022년부터는 후기 임상을 복합적으로 진행해 2024년 임상 3상을 완료하는 것을 목표하고 있다.
글로벌 사업개발도 함께 진행하고 있다. 2022년까지는 최적의 파트너링을 모색할 수 있는 글로벌 제약사에 기술이전하는 것을 목표로 사업개발 활동을 이어나가고 있다.
BBT-401의 임상 2상 중용량 및 고용량 시험이 올해초 시작을 앞두고 있다. 임상 진행 국가는 미국, 뉴질랜드, 폴란드, 우크라이나, 한국 등 5개국이다. 임상 사이트는 총 39곳이다. 중용량, 고용량 및 위약군 각각 12명씩 임상 참여 환자를 모집해 두 용량군 및 위약군 시험을 동시에 진행할 예정이다.
임상 대상 환자는 중증도에서 중증의 궤양성 대장염 환자로, 약물의 효능을 확인하기 위한 최적의 대상으로 설계됐다. 약물의 투약 방식을 새롭게 한 보충 시험도 앞두고 있다. 궤양성 대장염의 핵심 환부인 직장으로 직접 약물을 투약하는 신규 약물 작용기전 확인 임상시험도 조만간 시작한다.
위장부터 대장 부위별 인체 기관을 재현한 시험 모델인 SHIME(The Simulator of the Human Intestinal Microbial Ecosystem)을 활용해 개선된 제형이 궤양성 대장염의 주요 환부인 대장 말단과 소장 말단에 약물이 전달되는 성능을 한층 강화한 것으로 확인했다. 기존 제형 대비 대장 내 약물 전달능을 강화한 개선 제형을 향후 진행할 중용량 및 고용량 시험에 적용할 계획이다.