리보세라닙, 중국서 간암 2차 치료제로 시판허가
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
에이치엘비 로열티 수익 증가 기대
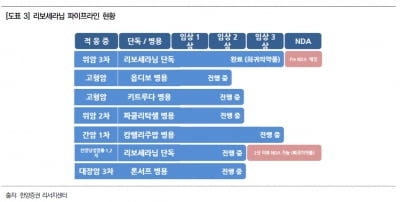
에이치엘비는 항서제약이 리보세라닙(중국명 아파티닙)에 대해 중국 국가약품감독관리국(NMPA)으로부터 간암 2차 치료제로 시판허가를 받았다고 8일 밝혔다.
리보세라닙은 2014년 중국에서 위암 3차 치료제로 판매허가를 받은 데 이어, 간암 2차 치료제로도 적응증(적용 질환)을 넓히게 됐다.
간암은 세계적으로 6번째로 많이 발병하는 암이고, 사망률은 4번째로 높은 질환이란 설명이다. 5년 생존율은 35.6%로 암 평균 생존율 70.4%의 절반 수준이다. 중국에서는 폐암에 이어 두 번째로 발생율이 높은 암종이다. 세계 간암 환자의 50% 이상이 중국 환자다.
항서제약이 시판 중인 위암 3차 치료제는 건강보험 급여 대상 품목에 등재돼 있다. 첫 시판된 2015년 약 550억원에서 2019년 약 3500억원으로 매출이 증가했다.
에이치엘비는 현재 간암 1차 치료제를 목표로 리보세라닙과 항서제약의 면역항암제 캄렐리주맙을 병용하는 글로벌 임상 3상을 진행 중이다. 캄렐리주맙과 리보세라닙이 모두 중국에서 간암 치료제로 시판허가를 받았다.
에이치엘비 관계자는 "간암 1차 치료제를 목표로 한 글로벌 3상의 환자모집이 마무리 단계에 있는 등 빠르게 진행 중"이라며 "위암 선낭암 간암을 적응증으로 한 리보세라닙의 상업화가 순차적으로 가시화되도록 할 것"이라고 말했다.
지난달 에이치엘비는 리보세라닙의 원개발자인 미국의 어드밴첸으로부터 글로벌 권리를 인수했다. 이에 따라 올해부터 항서제약으로부터 경상기술사용료(로열티)를 수령하게 된다. 이번 간암 치료제 승인은, 리보세라닙의 중국 내 매출 및 에이치엘비의 로열티 수익 증가로 이어질 것으로 보고 있다.
항서제약은 리보세라닙에 대한 유방암 비소세포폐암 난소암 등의 임상 3상을 진행 중이다.
한민수 기자 hms@hankyung.com
리보세라닙은 2014년 중국에서 위암 3차 치료제로 판매허가를 받은 데 이어, 간암 2차 치료제로도 적응증(적용 질환)을 넓히게 됐다.
간암은 세계적으로 6번째로 많이 발병하는 암이고, 사망률은 4번째로 높은 질환이란 설명이다. 5년 생존율은 35.6%로 암 평균 생존율 70.4%의 절반 수준이다. 중국에서는 폐암에 이어 두 번째로 발생율이 높은 암종이다. 세계 간암 환자의 50% 이상이 중국 환자다.
항서제약이 시판 중인 위암 3차 치료제는 건강보험 급여 대상 품목에 등재돼 있다. 첫 시판된 2015년 약 550억원에서 2019년 약 3500억원으로 매출이 증가했다.
에이치엘비는 현재 간암 1차 치료제를 목표로 리보세라닙과 항서제약의 면역항암제 캄렐리주맙을 병용하는 글로벌 임상 3상을 진행 중이다. 캄렐리주맙과 리보세라닙이 모두 중국에서 간암 치료제로 시판허가를 받았다.
에이치엘비 관계자는 "간암 1차 치료제를 목표로 한 글로벌 3상의 환자모집이 마무리 단계에 있는 등 빠르게 진행 중"이라며 "위암 선낭암 간암을 적응증으로 한 리보세라닙의 상업화가 순차적으로 가시화되도록 할 것"이라고 말했다.
지난달 에이치엘비는 리보세라닙의 원개발자인 미국의 어드밴첸으로부터 글로벌 권리를 인수했다. 이에 따라 올해부터 항서제약으로부터 경상기술사용료(로열티)를 수령하게 된다. 이번 간암 치료제 승인은, 리보세라닙의 중국 내 매출 및 에이치엘비의 로열티 수익 증가로 이어질 것으로 보고 있다.
항서제약은 리보세라닙에 대한 유방암 비소세포폐암 난소암 등의 임상 3상을 진행 중이다.
한민수 기자 hms@hankyung.com