회사는 '505(b)2 트랙'을 활용해 품목허가를 신청할 계획이다. 505(b)2는 FDA의 개량신약 허가제도다. 기존에 승인된 약물이 있는 경우 중복 자료를 면제해 임상 1상만으로 품목허가가 가능하다는 설명이다. 회사가 직접 연구하고 보유한 데이터는 물론 기존 승인 약물의 공공데이터를 활용할 수 있다. 신약허가 가능성이 높고 임상 비용 및 기간은 줄일 수 있다고 회사 측은 전했다.
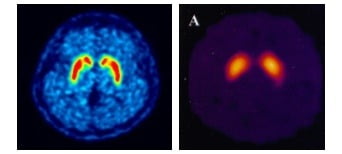
피디뷰는 퓨쳐켐의 '플루오린(F-18)' 표지 기술을 통해 세계 최초로 상용화한 파킨슨병 진단 신약이다. 뇌 속 도파민 운반체의 농도를 정량적으로 분석해 파킨슨병을 진단한다. 미국에선 피디뷰와 화합물이 같은 G사의 경쟁약물이 FDA 승인을 받은 상황이다.
미국은 현재 요오드(I-123) 표지 의약품이 널리 사용되고 있다. 피디뷰는 이 제품 대비 가격경쟁력이 있고, 빠르게 영상을 취득할 수 있다는 게 회사 측의 설명이다. 또 경쟁사의 'SPECT-CT' 방식 대신 'PET-CT' 방식을 채택해 영상 품질이 높은 것도 장점이라고 했다.
퓨쳐켐 관계자는 "미국 내 요오드 표지 의약품 시장은 연간 1억 달러 규모로 추산된다"며 "국내에서 사용되던 요오드 표지 방사성의약품을 피디뷰가 100% 대체한 사례가 있어, 미국 시장 상용화에 대한 기대가 높다"고 말했다. 이어 "피디뷰의 미국 진출을 위해 현재 미국 콜롬비아대와 연구자 임상계약을 체결하고 FDA 허가를 준비 중"이라고 했다.
파킨슨병은 알츠하이머병과 더불어 대표적인 신경퇴행성 질환 중 하나다. 뇌의 신경전달물질인 도파민이 분비되지 않아 발생한다. 미국 내 파킨슨병 환자수는 약 150만명으로 매년 6만명이 새롭게 발병하고 있다.
한민수 기자