이오플로우, 규제 강화 직전 유럽인증 취득…“불확실성 해소”
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
26일부터 유럽 의료기기 규제 강화
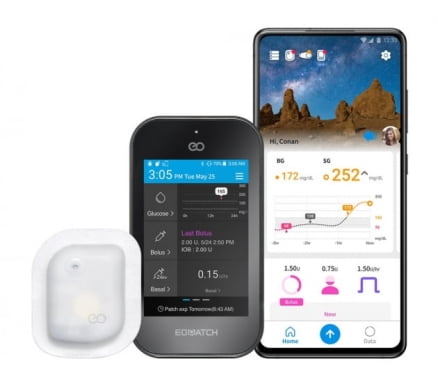
25일 이오플로우에 따르면 이번 인증은 이오패치 및 스마트폰형 컨트롤러(ADM)와 스마트폰 전용 앱(응용 프로그램)에 대한 유럽 의료기기 승인이다. 회사는 지난 3월 국내 최초 웨어러블 인슐린펌프를 출시한 데 이어, 유럽 인증까지 완료함에 따라 국내외로 제품 경쟁력을 입증했다고 설명했다.
이번 인증에 따라 이오플로우는 올 하반기 유럽 시장에 제품을 출시할 계획이다. 회사는 2019년 이탈리아 메나리니와 5년 간 1500억원 규모의 이오패치 독점공급 계약을 체결했다.
회사는 지난달 20일부터 이틀간 CE 인증을 위한 현장실사를 진행했으며, 서류 심사 등을 거쳐 이날 인증을 획득했다.
MDR 제도 시행을 하루 앞두고 인증 ‘막차’를 탄 셈이다. 26일부터는 유럽연합(EU) 시장에 출시하고자 하는 의료기기에 대해 강화된 제도인 MDR이 적용된다. 또 CE 인증 신청 시 ‘국제 의료기기 임상시험 실시기관 인증’(ISO14155) 규격을 바탕으로 한 임상데이터를 꼭 제출해야 한다.
의료기기 사용 결과 추적 및 사후관리도 강화된다. 제품 판매를 한 후에도 매년 시판 후 임상후속 조치와 사후 안정성 보고서 등을 정기적으로 제출해야 한다. 이와 함께 품목별로 전담 규제준수책임자를 의무적으로 배치하고, 책임자가 제품 인허가 과정은 물론 사후 평가 보고서 등을 전담한다.
기존 MDD를 대체하는 MDR은 2017년부터 3년간 시범기간을 거쳐 작년 5월 26일부터 적용될 예정이었다. 코로나19 유행으로 1년이 유예되면서 올 5월 26일부터 본격 시행된다. MDR은 효력이 발생하는 EU 전역에서 동시에 곧바로 적용된다.
강화되는 MDR 제도로 유럽에 대한 진입장벽이 높아질 것으로 우려되면서, 국내 의료기기 업체들도 제도 시행 전 적극적으로 인증 획득에 나섰다.
이오플로우 관계자는 “MDR 시행 전에 CE 인증을 획득해 유럽 진출 후의 부담 등 불확실성을 해소했다”며 “올 하반기 유럽 출시를 시작으로, 유럽 내 17개 주요 국가는 물론 캐나다 호주 남미 등 유럽 인증을 사용하는 주요 국가에 이오패치를 판매할 수 있도록 모든 역량을 집중할 것”이라고 말했다.
김예나 기자



![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


