2단계로 나눠 안전성·면역원성 평가
이번 임상은 두 단계로 진행된다. 우선 45명의 피험자를 대상으로 3개군으로 나눠, mRNA를 각각 50·100·200㎍(마이크로몰) 투여한다. 이를 통해 안전성과 면역원성을 평가한다.
이후 2개 용량의 투약군으로 압축해, 125명을 대상으로 하는 두 번째 단계를 연이어 수행할 예정이다. 단계별로 각각 서울아산병원 감염내과 및 다기관에서 진행한다.
승인되면 국내 최초의 mRNA 기반 코로나19 백신 임상이 된다.
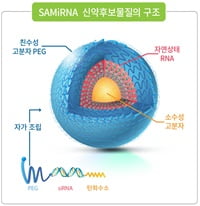
EG-COVID에는 기존 지질나노입자(LNP) 방식이 아닌, 아이진 고유의 양이온성리포좀이 적용됐다. LNP에 포함된 ‘PEG’ 성분이 포함되지 않아, LNP 기반의 mRNA 백신보다 안전성이 높을 것으로 기대하고 있다.
또 변이 바이러스에 대한 면역원성도 높을 것으로 봤다. 우한형 바이러스에 기반을 둔 기존 mRNA와 달리, 유럽발 변이인 ‘D614G’ 바이러스 기반의 mRNA를 사용했기 때문이다.
이와 함께 동결건조 제형으로 생산이 가능해, 영상 2~8도의 냉장 보관이 가능하다. 제품 승인 이후 국내 유통은 물론, 초저온 냉각 시스템을 확보하기 어려운 해외 시장을 대상으로 수출 경쟁력을 높일 수 있다고 보고 있다.
아이진은 현재 변이 바이러스에 대한 전임상 동물실험을 지속하고, 하반기에 새로운 변이 바이러스에 대한 전임상도 병행할 예정이다.
아이진 관계자는 ”식약처 및 임상연구윤리심의위원회(IRB)의 승인 후 임상시험 계획에 따라 단계적인 투약을 진행할 예정“이라며 ”하반기 중간 평가결과를 기반으로 최대한 빠르게 후속 임상 진입을 준비할 것“이라고 말했다.
이어 “후속 임상과 상업화를 위한 생산설비를 구축해 원부자재 확보에도 만전을 기하고 있다”며 “상업 생산을 위해 국내 기업들과 협업해 일부 소재의 국산화 연구 역시 진행 중“이라고 했다.
김예나 기자