이런 위험성을 인지한 미국 고등연구계획국(DARPA)은 팬데믹에 대응하기 위한 치료제 개발을 60일로 단축시키는 프로젝트를 시작했다. 약 두 달 만에 항체 치료제가 개발되려면 어떻게 해야 할까.
CAR-T, 이중항체, ADC… 항체 강점 극대화한 모달리티들
우선 바이러스가 인체에 침투하는 통로, 코 로나19 바이러스를 예로 들자면 스파이크 단백질에서 인체의 ACE 단백질에 결합하는 부위(RBD)를 찾아야 한다. RBD에 높은 친화도로 결합하는 항체를 골라내야 하기 때문이다. 이렇게 선별한 항체는 대부분 바이러스가 세포 내로 침투하는 것을 막을 수 있다.
이 단계에서는 단백질 도킹(docking) 방법이 유용하게 사용될 수 있다. 단백질 도킹은 항체가 표적 단백질의 RBD에 결합해 이루는 복합체 구조를 인실리코에서 예측하는 방법이다. 이 기술을 이용하면 RBD에 결합하는 중화항체를 선별하는 시간을 획기적으로 줄일 수 있다.
문제는 현재 3차원 구조가 밝혀져 있는 항체 가 5000개 수준이라는 점이다. 컴퓨터를 이용한 단백질 도킹으로 항체를 선별하기에는 수가 매우 모자라는 상황이다. 항체 구조상 3차원 구조를 밝히기가 까다롭기 때문이다.
항체는 중사슬과 경사슬, 2개의 폴리펩타이드로 이뤄져 있기 때문에 이 둘을 조합해 3차원 구조를 예측해야 한다. 이런 어려움 때문에 1개의 폴리펩타이드로 이뤄진 유사 항체, 단백질 스캐폴드를 이용하려는 시도가 늘어나게 됐다.
① 어피바디(Affibody)
여러 종류의 단백질 스캐폴드 중 가장 대표적인 것이 ‘어피바디’다. 스웨덴의 바이오텍인 어피바디가 개발한 유사 항체로, 황색포도상구균(staphylococcus aureus)의 세포막에 존재하는 IgG 항체에 결합하는 ‘프로틴 z(protein z)’의 도메인을 기반으로 개발됐다.
어피바디는 58개의 아미노산 잔기로 이뤄져 있어 약 6500달톤(Da)의 분자량을 가진다. 15만 Da인 항체와 비교하면 20분의 1보다 작은 크기다.
어피바디는 파지 디스플레이로 아미노산 13개에 돌연변이를 도입해 다양한 종류의 라이브러리를 생산하고 있다. 어피바디는 현재 다양한 어피바디의 임상시험을 진행 중이며 IL-17A 저해제인 ‘ABY-035’의 건선성 관절염에 대한 임상 2상 시험을 진행하고 있다.
어피바디의 가장 큰 장점은 신속한 제조 공정이 가능하다는 점이다. 분자량이 작고 구조가 간단하기 때문에 신속한 제조가 필요한 경우 화학적 합성이 가능하다. 이는 코로나19와 같이 신속한 치료제 개발이 필요한 경우 매우 유용하다.
또 항체와 달리 대장균과 같은 무핵 세포에서도 생산이 가능해 유핵 세포를 이용해야 하는 항체의약품보다 신속하게 대량생산 공정을 확립할 수 있다.
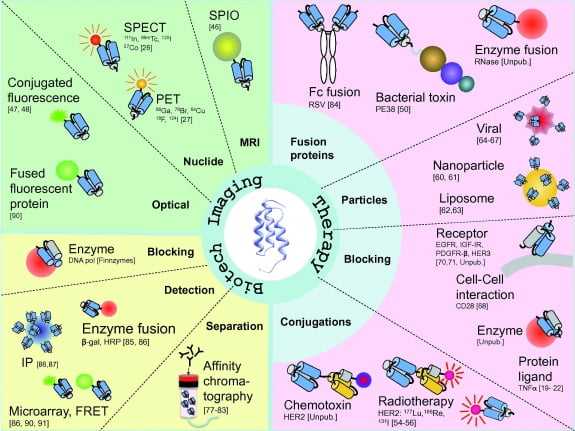
<어피바디를 활용한 여러 응용 연구>
모노바디(monobody)로도 불리는 ‘애드넥틴’은 제3형 인간 파이브로넥틴의 10번째 도메인(FN3)을 바탕으로 한다. 파이브로넥틴은 혈청에 있는 당단백질로 매우 높은 농도로 존재한다. 세포외기질에도 많은 양이 존재하는 것으로 알려져 있다.
현재 방사성동위원소로 표지된 ‘PD-L1 애드넥틴(18F-BMS-986192)’은 비소세포폐암 환자의 면역항암 항체 치료 여부를 결정하는 진단 제제로 임상시험을 진행하고 있다. PD-L1의 발현이 높은 환자를 선별하는 데 사용될 예정이다.
브리스톨 마이어스 스큅(BMS)은 애드넥틴 근이영양증 치료제를 개발하고 있다. 근육 발달을 저해하는 단백질로 알려진 마이오스타틴에 결합하는 물질로 현재 임상을 진행하고 있다.
③ 아피머(Affimer)
아피머는 식물 유래의 파이토스타틴을 기반으로 하고 있으며, 100개의 아미노산 잔기로 구성돼 있다. 흔히 9개의 아미노산을 무작위화(randomization)해 다양성을 확보한다. 식물 유래의 펩타이드이기 때문에 인체 투여 시 면역원성의 문제가 있다. 이 때문에 주로 진단용 항체로 개발되고 있다.
④ DARPin 스캐폴드
DARPin 스캐폴드는 자연계에 널리 존재하는 안키린(ankyrin) 단백질 도메인을 이용한다. 이 도메인은 단백질과 단백질 간의 상호작용을 중개하는 역할을 한다. DARPin 라이브러리는 33개의 아미노산으로 이뤄진 ‘안키린 반복 모티프 (ankyrin repeat motif)’ 4~5개로 구성된 형태로 개발된다. 파지 디스플레이, 리보솜 디스플레이를 통해 생성한다.
혈관내피성장인자(VEGF)에 결합하는 DARPin이 PEG(PolyEthylene Glycol)에 결합한 형태인 애브비의 ‘아비시파(abicipar)’는 현재 미국 FDA에 습성 노인성 황반변성 치료제로 승인을 신청한 상태다.
⑤ 압타머(Aptamer)
단백질 스캐폴드가 아닌 RNA 혹은 DNA 분자인 압타머도 개발되고 있다. VEGF 압타머가 PEG에 결합된 형태인 화이자의 ‘페가파닙(pegaptanib)’은 2004년 습성(노인성) 황반변성 치료제로 미국 FDA의 판매허가를 획득했으나, 현재는 경쟁력 약화로 판매되고 있지 않다.
현재 섬유아세포성장촉진인자2(FGF2) 압타머인 ‘RMB-007’이 습성 황반변성 치료제로 임상 2상 시험, 연골무형성증을 대상으로 임상 1상 시험이 진행되고 있다. 국내에서는 압타머사이언스가 당뇨병과 간암을 대상으로 전임상 개발을 진행 중이다.
아직 극복해야 할 허들도 남아 있어
전통적인 항체의약품의 단점을 많이 보완하고 있지만, 유사 항체에도 허들은 남아 있다.
우선 단백질 스캐폴드의 경우 작은 분자량 때문에 신장에서 쉽게 제거되기 때문에 혈중 반감기가 매우 낮다는 단점이 있다.
이를 극복하기 위해 아비시파와 같이 PEG를 화학적으로 결합하기도 하고, 항체의 불변영역(Fc)의 분절을 이용하는 중합 단백질 형태로 개발하기도 한다. 20일 전후로 긴 반감기를 가진 혈중 알부민에 결합하는 단백질 스캐폴드를 결합한 중합 단백질도 있다.
또 다른 문제점은 면역원성이다. 초기 유사 항체 의약품에 속하는 ‘칼비토’의 사례를 보자. 칼비토는 혈장 내 단백질 가수분해 효소인 칼리크레인(kallikrein) 저해제다. 사람의 지단백질 관련 응고 억제제(Lipoprotein- Associated Coagulation Inhibitor)의 첫 번째 도메인을 기반으로 하고 있다. 다이액스 코퍼레이션이 개발한 칼비토는 2009년 FDA로부터 유전성 혈관부종 치료제로 판매 허가를 받았다.
하지만 다수의 환자에게 투여한 결과 칼비토가 심한 알레르기 반응을 유도할 수 있다는 것이 밝혀졌다. 칼비토가 사람 유래 단백질 임에도 불구하고, 면역원성을 보이는 것은 단백질 엔지니어링 과정에서 도입된 돌연변이 때문인 것으로 보인다.
실제로 사람 항체 또한 항원에 대한 친화도 성숙 과정에서 체세포 과돌연변이 과정을 거치며, 이런 돌연변이가 면역원성을 불러일으킨다고 알려져 있다. 심지어 동물 유래 항체를 인간화한 인간화 항체와 유사한 면역원성을 보인다.
단백질 의약품의 면역원성은 T세포 의존성 혹은 T세포 비의존성으로 생성될 수 있다. 지금까지의 연구를 보면 주로 T세포 의존성으로 생성된 항체 반응이 더 중요한 것으로 보인다.
현재는 단백질 의약품에 존재하는 T세포에 피토프를 선별해내고, 돌연변이를 도입해 에피토프를 제거하는 기법이 개발돼 단백질 의약품 개발과정에 활발히 이용되고 있다.
T세포 에피토프의 경우 단백질이 세포 내에서 펩타이드 절편으로 분해된 다음, 인간 백혈구 항원(HLA·Human Leukocyte Antigen)에 결합해 세포막에 전시되고, 이를 T세포 수용체가 인지한다. 따라서 모두 선형(linear) 에피토프다. 반면 항체가 인지하는 B세포 에피토프는 90% 이상이 형태학적인 에피토프로서, 예측하는 것이 매우 어렵지만 점차 예측 기술이 개발되고 있다.
항체의약품 산업이 급속한 성장을 지속하면서, 항체 생산 및 정제 공정의 효율이 극대화되고, 위탁개발생산(CDMO) 업체가 다수 설립되면서 각각의 생산공정 개발이 필요한 이러한 단백질 스캐폴드의 장점이 많이 퇴색된 것이 사실이다.
하지만 작은 분자량을 지닌 낙타와 라마 항체인 VHH 나노바디가 코로나19 바이러스를 중화시키는 데 효과를 보인다는 사실이 밝혀지며, 항체 유사체에 대한 관심이 다시 증가했다.
VHH 나노바디는 통상적인 항체의 에피토프가 아닌 RBD의 다른 부위에 결합하고, 이 부위가 코로나19 바이러스 변이체들에서 일관된 구조를 지니고 있다는 것이 증명됐다.
항체가 결합하는 부위에 돌연변이가 축적되면 이 바이러스가 쉽게 전파돼 변이체가 되지만, 항체가 결합하지 않는 부위에는 돌연변이가 잘 축적되지 않기 때문이다.
궁극적으로 단백질 스캐폴드, 압타머, 나노바디 등의 아미노산 서열로부터 3차원 구조를 정확하게 예측하는 일이 가능해지면, 다양한 목표 분자에 결합하는 유사 항체 의약품 개발 속도가 획기적으로 빨라질 것이다.<저자 소개>

서울대 의대 졸업 후 동 대학 의학과 생화학교실에서 박사학위를 받았다. 항체의약품 개발의 메카인 미국 샌디에이고 스크립스 연구소에서 연구원으로 근무하다가, 2000년부터 서울대 의대 교수로 재직하고 있다. 개발한 항체의약품 1개가 임상 2상 시험 중이고, 1개의 CAR-T 치료제가 임상시험계획 승인 단계에 있다. ‘Antibody Society Korea’의 회장을 역임했다.
*이 글은 <한경바이오인사이트> 매거진 2021년 8월호에 실렸습니다.