'1+3 제한' 의약품 허가신청 시 임상자료 '공동' 여부 필수 입력
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
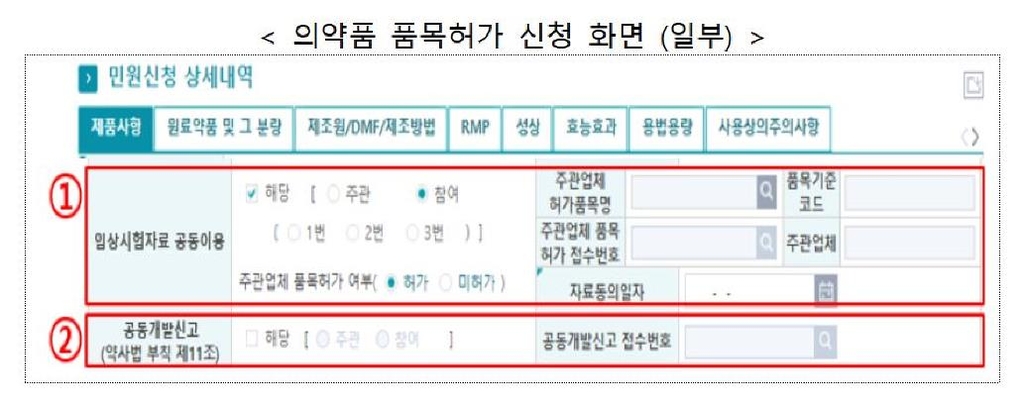
앞으로 식품의약품안전처에 의약품의 품목허가를 신청할 때는 임상시험 자료를 공동으로 이용하는지와 공동 개발하는지 등을 반드시 알려야 한다.
동일한 임상시험 자료를 활용해 추가로 허가받을 수 있는 의약품 품목 수를 3개까지로 제한하는 이른바 '1+3 제도'가 시행된 데 따른 것이다.
식약처는 '임상시험 자료 공동이용 제한(1+3) 제도'가 약사법 개정으로 시행된 데 따라 의약품 품목허가·신고 신청 시 작성해야 하는 항목과 입력 요령을 27일 안내했다.
제도 시행에 따라 의약품 품목허가·신고를 신청할 때 새롭게 입력해야 하는 항목은 임상시험 자료 공동이용 또는 공동개발 신고다.
임상시험 자료 공동이용 항목은 임상시험 자료를 공동으로 이용한 품목의 경우 작성해야 한다.
신청 업체가 임상을 주관하거나 임상에 참여했는지 등의 역할을 입력한다.
임상을 주관한 업체의 품목 허가 정보도 입력해야 한다.
다수의 의약품 제조업자가 공동으로 복제약 등을 개발하기로 하고 임상을 승인받은 경우에는 공동개발 신고 항목을 입력해야 한다.
식약처는 "임상시험 자료 공동이용 제한 제도가 안정적으로 정착되면 제약업계의 경쟁력이 강화될 것으로 기대한다"고 밝혔다.
의약품 품목허가·신고 신청에 대한 자세한 사용법은 의약품안전나라 공지사항에 게시된 사용자매뉴얼에서 확인할 수 있다.
/연합뉴스
-
기사 스크랩
-
공유
-
프린트



![뉴욕증시, PCE 대기하며 강보합...네이버웹툰 10%↑ [출근전 꼭 글로벌브리핑]](https://timg.hankyung.com/t/560x0/photo/202406/B20240628062256643.jpg)







![[오늘의 arte] 티켓 이벤트, 짐 아비뇽: 21세기 스마일 展](https://timg.hankyung.com/t/560x0/photo/202406/AA.37183633.3.jpg)