
이 제목은 필자의 것이 아니라 마이클 엘러 박사가 <임상신경과학 혁신저널(Innovations in Clinical Neuroscience)> 제15권에 쓴 해설(commentary) 논문 제목이다. 미국 듀크의과대학(Duke Medical School)의 스타 신경과학 교수였던 엘러 박사는 제약사 화이자를 거쳐 2010년부터 바이오젠에서 CNS그룹을 이끌고 있다.
뇌과학의 발전·정교해지는 이미징 기술… CNS 신약 개발 더 크게 발전할 것
엘러 박사는 위험성이 크고 너무 어려워 확실성이 부족한 신경과학과 CNS 신약 개발 시장이 낙관적인 미래를 꿈꿀 수 있는 몇 가지 이유를 든다.
첫째는 빠르게 발전하고 있는 신경과학에서 세포와 분자 레벨에서 시냅스와 뇌회로에 대한 이해가 깊어진 것에 주목한다. 둘째는 많은 뇌 관련 질환에 유전적 요인의 발견으로 병인에 대한 이해가 넓어지고, 그에 따라 치료제 가설 세우기가 비교적 용이해졌다.
셋째는 정교해진 기능적 자기공명영상(fMRI), 생세포 이미징(live cell imaging) 기술 등 이미징 기술 발전과 함께 칼슘인디케이터 시리즈(GCaMP series)로 더 섬세해진 기능 분석이 엄청난 공헌을 하고 있다. 각종 신기술, 유체 바이오마커 등을 이용한 뇌기능의 정량적 관찰이 가능해진 것이다.
넷째는 다양한 치료제 접근 방식, 예를 들어 뇌척수 내 안티센스 올리고 뉴클레오티드, 아데노 관련 바이러스 유전자 치료, 세포 치료법과 뇌 침투 생물 제제 등이 생겨난 것이다.
마지막으로 규제 당국의 적극적이고 새로운 접근 방식과 벤처캐피털(VC), 신경과학 스타트업의 활발한 움직임이 활로를 만들고 있다. 규제 당국은 일단 바이오마커 기반 병 진단과 신약 효능 테스트로 가는 것을 허용하겠다고 밝혔다.
필자가 주목하는 것이 바로 이 마지막 부분이다. 신경과학 신약 개발도 결국 항암제 개발과 마찬가지로 바이오마커와 유전자 분석을 통한 타깃 환자를 선별해 임상시험을 진행하면 더 높은 찬스가 오는 것이다.
치매 발병 원인의 70% 이상이 바로 알츠하이머병(AD)이다. 알츠하이머병은 다양한 지적 기능의 상실을 가져오는 퇴행성 신경질환이다. AD와 파킨슨병(PD)에 본격적으로 투자 한 지난 15년 동안 크고 작은 제약사, 바이오텍이 개발에 도전했지만 투자에 대한 수익은 없는 상태다. 신약 개발의 결과는 2021년까지는 거의 백전백패다. 그러나 많은 전문가의 예상과 다르게 미국 식품의약국(FDA)은 지난 6월 7일 바이오젠의 ‘아두카누맙’을 신속 승인했다.
말도 많고 탈도 많은 아두카누맙을 바로 뒤쫓고 있는 것은 무엇일까. 일라이릴리는 지난 3월 도나네맙(LY3002813)의 ‘TRAILBLAZER -ALZ’ 2상 시험의 톱라인 데이터를 발표했고, 이 데이터를 기반으로 6월 FDA로부터 혁신치료제 지정을 받았다.
일라이릴리는 올해 7월 29일 알츠하이머협회 국제회의(AAIC·Alzheimer’s Association International Conference)에서 도나네맙의 TRAILBLAZER-ALZ 데이터에 대한 두 가지 탐색적 분석 결과를 발표했다.
첫 번째 데이터는 도나네맙 치료 후 아밀로이드 플라크 변화가 더 큰 환자에서 인지 저하가 더 느린 것을 보여주었다. 도나네맙은 초기 증상이 있는 알츠하이머병 환자에서 24주 째에 빠른 아밀로이드 플라크 감소를 유도했고, 베이스라인에서 플라크 부담이 가장 심각 했던 참가자에게서 가장 빠르게 제거되는 것으로 나타났다.
24주에 완전한 아밀로이드 플라크 제거에 도달한 참가자 하위그룹(아밀로이드 수준 <24.1CL)은 다른 환자보다 더 일찍 도나네맙 투여를 중단하거나 감량할 수 있었다. 24주에 완전한 아밀로이드 플라크 제거를 달성하고 위약으로 맹검 전환한 사람들은 노출-반응 모델에서 이후 12개월간 최소한의 아밀로이드 재축적을 보였다.
또 24주에 조기(早期) 완전 아밀로이드 플라크 제거 상태에 도달한 사람들은 76주에 양전자단층촬영(PET)에서 위약 대비 알츠하이머병 진행에 대한 예측 바이오마커인 타우 확산이 전두엽, 두정엽, 측두엽에서 유의하게 감소한 것으로 나타났다. 24주에 아밀로이드 플라크 변화가 더 큰 것은 통합 알츠하이머병 평가 척도(iADRS) 점수 개선과 관련 있었다.
약동학·약역학 모델링 결과, 상대적으로 아밀로이드 플라크 제거율이 높을수록 임상적 이점이 더 큰 것으로 관찰됐다. 도나네맙 임상 2상 시험의 결과는 지난 3월에 국제학술지 <뉴잉글랜드 저널 오브 메디신(NEJM)>에도 동시 게재됐다.
아두카누맙, 도나네맙 등 알츠하이머 신약 경쟁도 활발해
승인 이후 계속 말도 많고 탈도 많은 아두카누맙과 일라이릴리의 도나네맙은 같은 단항체(Monoclonal Ab)이지만 무엇이 다른가. 같은 아밀로이드베타(Aβ) 항체라고 해도 Aβ의 어떤 부분(에피토프)을 타깃하는가가 중요하다. 항체가 어떤 부분에 결합하는지에 따라 단량체(모노머), 플라크, 용해가능(soluble)· 용해불가능(insoluble) Aβ 등 전혀 다른 특성을 지닐 수 있기 때문이다.
아두카누맙은 이전 항체들과 다르게 치매증상이 없거나 치매증상 진행속도가 느린 노인들의 B세포에서 발현되는 유전자 풀에서 선별했다. 아두카누맙은 에피토프인 Aβ의 3~6번째 아미노산에 결합해 Aβ의 단일체에는 붙지 않고 뭉쳐 있는 구조를 인지해 붙으며 또한 뭉쳐진 플라크를 녹여낸다.
도나네맙은 N3pG라는 Aβ 플라크의 변형된 형태를 표적하는 항체다. Aβ의 N-터미널 2번째 아미노산과 3번째 아미노산 사이가 잘라지면 새로운 N-터미널의 글루타민산이 글루타미닐 사이클레이즈(glutaminyl cyclase) 효소에 의해 변형되고 이 변형된 Aβ는 강한 접착력으로 인해 아밀로이드 플라크를 형성하는 씨앗으로 알려졌다.
변형된 아밀로이드베타(pyroGlu-Aβ)를에 피토프로 사용한 항체가 바로 도나네맙이다. 에피토프의 이런 두 항체의 작은 차이가 효과의 큰 차이로 이어질까.
일부 기억력 상실이 노화와 관련이 있다는 사실은 잘 알려져 있다. 이전에 알던 사람의 이름을 잊기도 하고, 자동차 열쇠를 어디에 두었는지 잊기도 한다. 하지만 단순한 노화현상을 넘어, 이런 식의 기억력 상실이 일상생활 영위에 어려움을 유발하고 발생 빈도가 높아진다면 가벼운 기억력 상실 단계(MCI·Mild Cognitive Impairment)를 의심해봐야 한다.
그러나 MCI는 질병의 명칭은 아니고, 단지 사고 능력과 정보 처리 능력에 변화를 가져오는 모든 증세를 통틀어 일컫는 용어에 해당된다. 기억력의 문제 발생을 MCI의 가장 흔한 지표로 삼는다. MCI가 있는 사람은 자연스러운 노화 증세보다 더 심각한 판단력 저하와 사고· 언어 문제로 어려움을 겪는다. 하지만 평상시 본인들이 하던 활동을 대부분 할 수 있고 독립적인 생활을 이어갈 수 있다. 그리고 MCI를 가진 모든 사람이 치매에 걸리지는 않는다.
p-Tau217이 혈액 바이오마커의 스타로 떠올라
혈액에서 어떤 것을 검사해야 MCI와 알츠하이머를 더 정확하게 구분하여 진단할 수 있을까. 알츠하이머 조기 진단과 치료제 개발에 있어서 중요한 요소가 바이오마커이기에 ‘A/T/N’ 시스템이 고안됐다.
‘A’는 아밀로이드, ‘T’는 타우, ‘N’은 신경퇴행성(neurodegeneration)을 의미한다. 각각을 진단하는 PET 방법이 존재하고, 혹은 뇌척수액(CSF)에서 각각의 인자를 측정하는 방법도 존재한다. 이 시스템에 따라 개개인을 A+/T+/N- 혹은 A+/T+/N- 등으로 분류할 수 있다.
환자들에게서 CSF를 채취하는 것은 허리 척추에 긴 바늘을 찔러 척수액을 얻는 방법으로 매우 침습적인 문제가 있어 치매 조기 병변의 진단용으로는 부적절하다. PET도 뇌에 방사선 동위원소가 들어가고 사진을 병원에 가서 찍는 것이 부담스럽다.
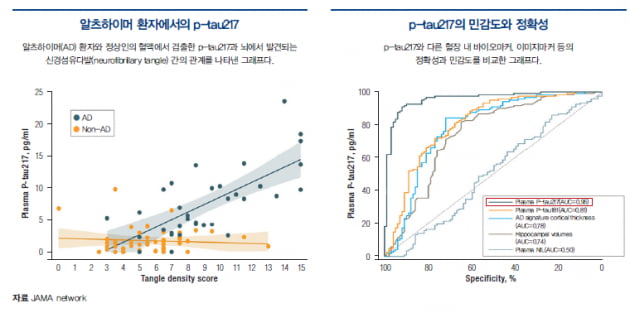
지난 7월 말 AAIC에서 공개된 데이터는 정말 흥미롭다. 알츠하이머병 병리를 나타내는 CSF나 PET도 아니고 혈액 바이오마커인 p-Tau217에 초점을 맞췄다. 도나네맙 치료는 12주 이내 조기에 이 혈장 바이오마커를 상당하게 낮추는 것이다. 위약과 비교해 도나네맙 치료가 p-Tau217의 빠른 감소를 일으키고, 3개월(12주) 시점까지 상당한 감소를 보였다. 감소된 p-Tau217은 24주 및 76주 모든 시점에서 아밀로이드 변화와 유의한 상관관계를 보였다.
타우를 단면으로 보는 p-Tau217이 어떻게 알츠하이머병 병리를 나타내는 가장 중요한 혈액 바이오마커가 되었는가.
이전까지는 사후 부검을 통한 진단이 가장 일반적이었다. 그런데 바로 1년 전 AAIC(virtual)에서 p-Tau217이 갑자기 무대 중심의 스타가 됐다.
한 연구에서는 AUC(Area Under the Curve)가 특이성과 민감성을 나타내는데 p-Tau217이 0.98로 거의 100% 근접한 정확 도로 알츠하이머병 환자를 진단할 수 있었다. 또 다른 연구에서는 AD와 퇴행성 신경계 질환을 분명히 구분했다. 다른 혈장 바이오마커인 NfL(Neurofilament Light)이나 p-Tau181보다 p-Tau217의 정확도가 더 우수했다.
사람이 나이가 들면 노화 현상 때문에 Aβ에 어느 정도 노출된다. 지금까지 Aβ를 겨냥하는 항체들이 오랫동안 수모를 겪게 하는 임상 실패의 결정적인 이유는 기억력 감퇴에 효과가 있는 것을 증명할 수 없었기 때문이다.
지난 7월에 일라이릴리가 발표한 두 데이터를 합치면 도나네맙이 초기 증상이 있는 알츠하이머병 환자의 아밀로이드를 제거하는 것이 질병 진행을 늦출 수 있기에 환자에게 임상적 혜택을 준다는 것이다. ‘아밀로이드 캐스케이드(Amyloid Cascade)’, 즉 Aβ가 존재할 때 타우의 병리적인 과인산화와 응집이 가속되는 ‘아밀로이드베타-타우 축(Aβ-Tau axis)’이 발생한다.
도나네맙의 작용 기전인 아밀로이드 플라크 제거가 인지 저하의 바이오마커인 p-Tau217이 감소하면서 기억력 감퇴가 둔화하는 것을 보여준 긍정적인 임상결과라는 점에서 중요하다.
임상 3상은 55세와 80세 사이의 참가자를 대상으로 정했다. 일라이릴리는 이번 3상을 통해 알츠하이머 약의 가장 중요한 요소인 기억력 감퇴에 효과가 있는 것을 증명하는 것이 목표다. p-Tau217이 건강한 일반인과 아밀로이드 플라크를 가졌기에 알츠하이머 가능성이 높은 사람을 구별할 것이라고 에릭 레인만 배너 알츠하이머 연구소 박사는 기대한다.
어떤 ‘프롤린 의존적 키나아제’가 타우 인산화를 시작하는가
최근까지 알츠하이머병 병리를 나타내는 바이오마커를 확인하는 가장 강력하고 확실한 방법은 사후부검(postmortem)이었다. 우리 말로 부검 또는 검시라고 하는 죽은 자의 뇌 샘플에서 타우 단백질의 어디가 인산화되고, 어디가 아세틸화됐는지 환자 단백질을 뇌에서 꺼내 정상인과 비교 분석해 알아내는 방법이다.
일반 단백질이 2·3차 구조를 가지고 있는 것과는 달리 타우는 미접힘(unfolded) 단백질이기 때문에 구조를 관찰하는 데 어려움이 있다. 그러기에 타우를 관찰하는(seeing) 연구가 알츠하이머병 연구의 돌파구를 가져올 것이다. ‘본다(seeing)’는 것의 의미는 구조를 측정한다는 의미뿐만 아니라 상호작용을 측정한다는 의미도 포함한다.
타우를 단면으로 보는 p-Tau217이 어떻게 알츠하이머병 병리를 나타내는 가장 중요한 혈액 바이오마커가 됐을까. 이에 대한 답을 생각할 수 있는 관점이 나왔다. 최근 국제학술지 <사이언스>에 카즈 블렌노 박사가 ‘혈액 검사로 확인하는 알츠하이머 표현형(Phenotyping Alzheimer’s disease with blood tests)’이라는 제목으로 정리했다.
사람에게서 가장 긴 441개 아미노산의 ‘타우 동형단백질(isoform)’이 인산화된 후에는 254개 아미노산 타우로 잘려 CSF와 혈액으로 방출된다.
이 중에 주 인산화된 타우가 p -Tau181, p-Tau217, p-Tau231이다. 이미 1년 전 AAIC, 알츠하이머협회국제회의(virtu al)에서 p-Tau217이 p-Tau181을 제치고 갑자기 주목을 받았다. 다른 혈장 바이오마커인 NfL이나 p-Tau181보다도 p-Tau217의 정확도가 98%에 가깝게 더 우수했다.
타우 단백질의 아미노산 순서를 확인했을 때 p-Tau181, p-Tau217, p-Tau231은 똑같이 ‘트레오닌(Thr)-프롤린(Pro)-프롤린(Pro)’을 가지고 있기에 놀랐다. 우연의 일치일까. 아니다. 트레오닌이 인산화되고 연이어 프롤린이 하나도 아니고 두 개가 계속되면 단백질 구조의 변화(conformational change)가 만들어지는 것이다.
또 하나 연결 가능성은 Pin1이란 이성질화 효소다. Pin1은 ‘peptidyl-prolyl cis/trans isomerase(PPIase)’이다. 타우의 트레오닌이 인산화되면 ‘Pin1 이성질화 효소’가 작용해 신경세포 사멸억제 작용을 한다. 이런 이성질화 효소 작용이 암과 알츠하이머에 중요한 역할을 한다고 알려졌다. ‘Thr-Pro-Pro’은 눈여겨 봐야 할 시퀀스다.
타우는 한마디로 CNS에 존재해 미세관에 결합하고 또한 인산화되는 단백질이다. 타우 전체 아미노산 순서에서 보면 3개의 ‘Thr-Pro- Pro’ 외에도 ‘Thr-Pro’은 50, 69, 111, 153, 175, 205, 213, 235와 ‘세린(Ser)-프롤린 (Pro)’은 46, 199, 202, 396, 405, 422가 존재한다. 타우에 이렇게 통틀어 17개 Ser/Thr 사이트(site)가 인산화되고 연이어 ‘Pro’이 다음 아미노산으로 존재한다.
이들은 타우의 ‘마이크로튜불-바인딩 도메 인(MBD)’인 245~368번의 아미노산 순서보 다 아미노(NH2) 쪽인 ‘프롤린 다량 지역(Pro-rich region)’에 대부분 존재하지만 MBD의 카르복실(COOH) 쪽에도 3개가 존재한다.
그러면 이런 17개 세린-트레오닌 사이트를 인산화하는 proline-directed protein kinases(PDPK)는 과연 어떤 것일까.
3개의 타우 PDPK 키나아제는 GSK3β, CDK5와 PKA로 알려졌다. GSK3 기질(substrates)은 (S/T)XXX(S/T)이다. CDK5는 ‘proline-directed serine/threonine protein kinase’이면서 세포 주기(cell cycle)를 조절하는 ‘a member of cyclin-dependent kinases(CDKs)’다. 재미나게도 CDK5는 이름과 달리 세포 주기를 조절하는(cell cycle regulation) 역할은 가지고 있지 않다고 보고됐다. ‘cAMP-dependent PKA’는 ‘serine/threonine’을 인산화하는 키나아제이며 CNS에 많이 발현되고 있다.
타우 단백질이 응집해 형성되는 ‘타우 탱글’은 알츠하이머 등 퇴행성 질환을 일으키는 원인이다. 앞에 <사이언스>에서 언급한 대로 사람의 441개 아미노산의 ‘타우 동형단백질’이 인산화된 이후 254개 아미노산 타우로 잘려 CSF와 혈액으로 방출된다. 이 중에 주인산화된 타우가 ‘p-Tau181’, ‘p-Tau217’, ‘p-Tau231’이다. 이 세 가지 p-Tau 중에 타우 엉킴(tangle)을 시작하는 트레오닌은 누구일까.
올해 5월에 ‘p-tau231’이 알츠하이머 병리를 진단할 수 있는 새로운 바이오마커로 떠오른다는 논문이 발표됐다. 지금까지는 p-Tau181과 p-Tau217이 주목을 받았지만 새 강자가 나타났다. 혈장의 p-Tau231이 혈장의 p-Tau181보다 먼저 만들어진다. 더구나 ‘amyloid PET’으로 양성 판정이 나오기 전에 만들어지는 p-Tau231을 측정할 수 있다는 큰 장점을 가지고 있다.
그러기에 이 혈액 바이오마커는 정상적인 건강한 노화와 알츠하이머를 구별할 수 있고 알츠하이머병의 진전을 쫓아갈 수 있는 간편한 방법이기에 장점이 크다.
오래전부터 제일 먼저 알려진 인산화 부위는 ‘p-Thr-231’이다. 1997년 논문에 처음 발표된 ‘phospho-dependent N-terminal epitope’를 이용해 만들고 ‘TG-3’이라고 명명했다. 이후 알츠하이머 환자의 사후부검을 통해 가장 먼저 발병 시작점이 된다는 것을 보고한 여러 논문이 발표됐다.
p-Tau231이 사후부검을 통한 알츠하이머 진단에 99% 이상 정확성을 보이므로 아마 p-Tau231도 혈액에서 p-Tau217보다 동등 이상으로 좋은 바이오마커 역할을 할 것 같다고 필자는 가정하였다. 그러나 올 5월에 발표된 논문을 이제야 읽어보니 드디어 혈장에서도 알츠하이머의 중요한 바이오마커가 된 것이다.
‘플로타우시피르(Flortaucipir)’라는 PET은 환자의 뇌에서 특정 형태의 타우를 이미지화해 감지하는 진단법이다. 이를 적용한 임상 3상의 결과 보고에 따르면, 알츠하이머 환자의 뇌에서 타우의 접히고 얽힌 필라멘트 형태가 더 선명하게 감지되는 것으로 나타났다. 그래서 이 방법이 이미 오래전 상용화된 N과 A를 새롭게 대체할 수 있다고 주장하였다.
문제는 치매 중증도 분류 시스템인 ‘브락 스테이지(Braak stage)’에서 5기나 6기에서만 결과가 선명하다는 점이다. 이미 질환 진행도가 상당한 환자들이 대상이 되기 때문에 조기 진단으로서의 효과를 입증하지는 못했다. 그러나 p-Tau231은 브락 스테이지 3기 이전 상태도 알 수 있는 유일한 혈액 바이오마커다.
현재 상업용으로 퀀터릭스의 ‘Simoa(Single molecule array)’라는 기기로 알츠하이머를 가장 많이 측정하는데 2억 원 정도로 고가의 장비다. 그러나 ‘The Simoa Human Neurology 3-Plex A assay(N3PA)’는 ‘total tau, amyloid β 1-42’와 ‘amyloid β 1-40’을 동시에 측정한 뒤 바이오마커로 사용해 분석한다. 연구자들은 이번 알츠하이머 바이오마커 연구를 위해 ‘Simoa’를 이용해 ‘10~30pg/ml’, ‘p-Tau231’을 분명하게 감지할 수 있었다. 더구나 연구자들은 면역침강반응(immunoprecipitation)과 질량분석법(mass spectrometry)으로 결과를 검증하였다.
그러기에 곧 p-Tau231을 측정하는 ‘Simoa’가 완성되면 임상에서 ‘임상실험실 표준 폼’으로 사용될 것이다.
자연스러운 노화 증세를 경험하는 사람 혹은 MCI가 있는 분들은 간편하게 혈액에서 p-Tau231 측정을 통해 내 건망증이 알츠하이머가 아닌가 하는 의심에서 벗어날 수 있다. 무엇보다 알츠하이머 환자의 치료제로 사용되는 물질의 유용도를 손쉽게 평가하고 환자의 증상이 진전 혹은 좋아지는지 판단의 도구로 사용할 수 있다.
1970년대부터 본격적으로 시작된 항암영역 연구개발 때보다 요즘의 테크닉 발달 속도는 비교가 어려울 정도로 빠르다. 연구시작 후 항암 표적치료제들이 본격적으로 나오기 시작한 시기를 가늠하면 신경과학 연구가 본격 적으로 이루어진 지 15년 정도라 쳤을 때 언제쯤 CNS에 효과가 있는 신약이 폭발적으로 나올지 가늠할 수 있다.
여러 항암 신약이 나올 때보다 CNS 신약이 개발되어 나오는 기간은 훨씬 짧게 걸릴 것이다. 신경과학이 차세대의 항암 영역이 돼 빠르게 발전할 것이다.
<저자 소개>

미국 위스콘신대에서 박사과정을 마쳤다. 2008년 JW중외제약에서 연구총괄 전무를 지냈고 C&C신약연구소 대표를 역임했다. 한국아브노바 연구소장과 한독 상임고문을 거쳐 현재 이노큐어테라퓨틱스 부사장(Science intelligence advisor)이자 우정바이오 신약 클러스터 기술평가단장을 맡고 있다. 국내외 신약 개발 분야의 석학으로, 저서로는 <사람을 살리는 신약개발(Back to BASIC)>이 있다.
*이 글은 <한경바이오인사이트> 매거진 2021년 9월호에 실렸습니다.









