“한올바이오파마, 신약 탄생 기대… 美 불확실성은 한계”
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
신영증권 분석
신영증권은 15일 한올바이오파마에 대해 중국 내 안구건조증 신약(HL036) 탄생에 대한 기대감이 있다며 투자의견 ‘매수’를 유지했다. 다만 자가면역질환 치료제(HL161)의 미국 임상 재개 불확실성을 반영해 목표주가는 4만2000원으로 낮췄다.
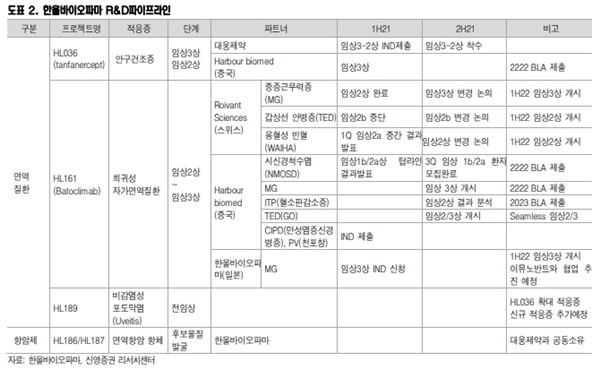
한올바이오파마는 지난 7월 대웅제약과 공동개발 중인 ‘HL036’의 임상 3-2상을 미국 식품의약국(FDA)에 신청했다.
이명선 연구원은 “이번 3-2상은 3-1상 결과를 기반으로 임상 대상자를 세분화하고 평가지표를 변경해 긍정적인 결과가 기대된다”며 “중국에서도 작년 말 3상을 시작, 내년에는 품목허가신청서(BLA) 제출이 가능할 것”이라고 전망했다.
자료 제공=신영증권
‘HL161’은 미국과 중국에서 임상시험 중이다. 하지만 연초 미국에서 콜레스테롤 수치가 상승하는 부작용이 발생해 임상이 중단됐다. 지난 6월 재개가 결정됐으나 임상 설계 점검 등으로 재개가 내년으로 밀렸다. 이에 개발 일정이 모호해졌다는 판단이다.
반면 중국 임상은 순항 중이다. 기존 4개 적응증 중 시신경척수염(NMOSD)과 중증근력증(MG)은 내년 중국 BLA 신청이 가시화됐다. 연내 신규 만성염증성신경병증(CIDP)과 천포창(PV) 임상도 개시할 것이란 예상이다.
경쟁사인 아제넥스는 지난 3월 'FcRn' 저해제 에프가티지모드를 중증근무력증 치료제로 FDA에 허가를 신청했다. 결과는 오는 12월17일 발표 예정이다.
이 연구원은 “의약품시장 분석 기업 이벨류에이트파마에 따르면 2026년 에프가티지모드의 매출은 30억달러(약 3조5160억원)로 전망된다”며 “이 같은 기대감을 고려해 HL161 가치 또한 재평가돼야 한다”고 판단했다.
이어 “지난해 HL161의 임상 3-1상 결과가 기대에 미치지 못하고, 미국 임상이 중단되며 주가가 하락했지만 개발 일정만 지연됐을 뿐 개발 추진력은 변함없다”며 “중국 내 사업화 가능성도 높아졌다”고 했다.
이도희 기자
한올바이오파마는 지난 7월 대웅제약과 공동개발 중인 ‘HL036’의 임상 3-2상을 미국 식품의약국(FDA)에 신청했다.
이명선 연구원은 “이번 3-2상은 3-1상 결과를 기반으로 임상 대상자를 세분화하고 평가지표를 변경해 긍정적인 결과가 기대된다”며 “중국에서도 작년 말 3상을 시작, 내년에는 품목허가신청서(BLA) 제출이 가능할 것”이라고 전망했다.

반면 중국 임상은 순항 중이다. 기존 4개 적응증 중 시신경척수염(NMOSD)과 중증근력증(MG)은 내년 중국 BLA 신청이 가시화됐다. 연내 신규 만성염증성신경병증(CIDP)과 천포창(PV) 임상도 개시할 것이란 예상이다.
경쟁사인 아제넥스는 지난 3월 'FcRn' 저해제 에프가티지모드를 중증근무력증 치료제로 FDA에 허가를 신청했다. 결과는 오는 12월17일 발표 예정이다.
이 연구원은 “의약품시장 분석 기업 이벨류에이트파마에 따르면 2026년 에프가티지모드의 매출은 30억달러(약 3조5160억원)로 전망된다”며 “이 같은 기대감을 고려해 HL161 가치 또한 재평가돼야 한다”고 판단했다.
이어 “지난해 HL161의 임상 3-1상 결과가 기대에 미치지 못하고, 미국 임상이 중단되며 주가가 하락했지만 개발 일정만 지연됐을 뿐 개발 추진력은 변함없다”며 “중국 내 사업화 가능성도 높아졌다”고 했다.
이도희 기자


![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


