약물 개발의 의미와 배경
항암약물 전달 치료제 개발 영역에서 가장 주목받고 있는 기술은 항체 기반 약물전달, 즉 항체약물 접합(ADC·Antibody-Drug Conjugate) 기술이다. ADC는 약물을 항체에 접합해 종양조직에 특이적으로 전달함으로써 부작용은 줄이고 효과를 높이는 혁신적인 기술이다.
글로벌 제약사들을 중심으로 활발한 연구개발이 진행되고 있고 일부 승인된 ADC 제제가 있지만 아직은 그 수가 많지 않다.
그러나 ADC는 개발과정에서 극복해야 할 장애물들로 인해 여전히 기대만큼의 임상적 치료 효과를 달성하지 못하고 있다. 특히 표적 발현율이 낮거나 전혀 발현되지 않는 정상조직으로 전달 시 발생되는 부작용 때문에 약물의 용량을 제한하여야 하는 점은 실제 개발과정에서 주된 실패 요인으로 작용하고 있다.
이는 혈액 내 수일에 달하는 항체의 긴 반감기와 낮은 조직 도달률에 기인한 것으로 ADC 개발의 주요한 장애물이 되고 있다.
핵산물질인 압타머는 표적 특이적 결합 특성과 작용 메커니즘으로 인해 항체와 비교되는 차세대 단백질 표적 결합 물질이다. 항체 대비 10% 이하의 작은 크기를 가지고 있어 조직투과율이 매우 좋다. 항체에 비해 짧은 혈액 내 반감기를 갖는 점은 약물로서 단점이 될 수 있지만, 약물 전달에서는 그만큼 정상조직에 대한 약물 노출 위험이 낮아질 수 있는 장점이 될 수 있다.
AST-201은 이러한 압타머의 특성을 약물 전달에 활용해 압타머사이언스가 개발하고 있는 첫 번째 압타머-약물 접합(ApDC·Aptamer-Drug Conjugate) 항암 파이프라인이다. 항암 표적 약물전달 기술영역에서 ADC의 단점을 극복할 수 있는 새로운 대안이 될 수 있을 것으로 기대하고 있다.
약물 특성 및 기전
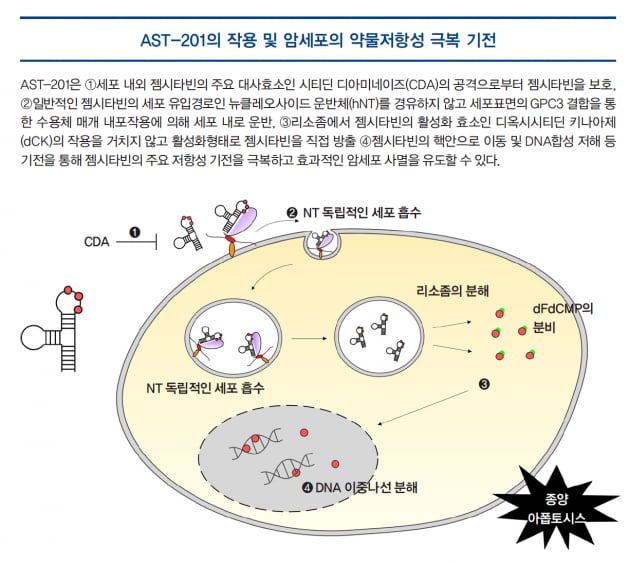
AST-201은 항암제인 젬시타빈을 항암표적 압타머 구조 내에 전구물질(prodrug) 형태로 내재화시킨 ApDC로 개발되었다.
AST-201의 표적은 GPC3(Glypican3) 단백질이다. GPC3은 발달과정에서 주로 발현되는 세포표면 당단백질로 세포분열 및 성장조절과 관련된 기능을 하지만 간암, 폐암을 포함한 다양한 암에서도 과발현이 관찰되고 있는 종양 바이오마커다. 특히 간암에서의 발현율이 높다. 전체 간암의 약 70%에 이른다. 이에 따라 GPC3을 표적으로 한 항체, ADC, CAR-T 등 다양한 항암제 연구개발이 진행되고 있다.
AST-201의 내재화 항암제인 젬시타빈은 매우 효과적인 화학항암제로 유방암, 췌장암, 폐암을 포함한 다양한 암의 치료제로 사용되고 있지만, 다른 화학항암제와 마찬가지로 종양의 항암제 내성과 부작용 문제로 인해 제한적으로 사용되고 있다.
압타머에 의한 항암 표적 특이성과 젬시타빈에 의한 암세포 사멸 기능이 한 분자 내에 동시에 구현된 AST-201은 체내에서 젬시타빈 특이적으로 작용하는 주요 비활성화 기전들로부터 젬시타빈을 보호할 수 있다는 것을 효능시험을 통해 입증했다. 또 과발현된 GPC3 단백질 표적에 매우 특이적이고 선택적인 압타머를 적용함으로써 항암제의 전신 부작용(systemic side effect)을 최소화하고 표적 특이적 항암효과를 극대화할 수 있도록 디자인됐다.
특히 ADC의 약물로 사용되는 약물에 비해 상대적으로 약한 독성을 보이며 이미 임상적으로 독성 프로파일이 검증된 항암제를 적용하고, 항체 대비 압타머의 짧은 반감기로 인한 전신노출의 최소화 및 높은 조직 투과율로 인해 ADC 개발의 주요 장애물인 ‘오프타깃(off-target)’ 부작용을 효과적으로 극복할 수 있다는 특성을 가지고 있다.
① 간암 치료제 개발 가능성
AST-201은 GPC3-양성의 암종에 대해 단독요법 치료제로 개발 중이다. GPC3의 발현율이 가장 높은 것으로 보고되고 있는 진행성 간암은 AST-201의 주요 표적 암종이다. 진행성 간암의 치료에는 티로신키나아제 억제제 계열 약물들이 주요 1, 2차 치료제로 사용되고 있으나 매우 제한적인 치료 효과를 보이고 있다. 대부분의 면역항암제들은 임상실험에서 유의성 확보에 실패하고 있다. 최근 티센트릭(면역항암제)과 아바스틴(VEGF항체)의 병용요법이 1차 치료제로 승인받았지만, 여전히 혁신적 치료법 개발 수요가 매우 높은 영역이다.
치료 약물로서 젬시타빈 자체는 간암에서 임상적 유의성 확보에 실패했다. 그러나 그 요인이 간에서 젬시타빈의 빠른 대사로 인한 비활성화로 파악되고 있으며, AST-201에 내재화된 젬시타빈은 이러한 대사효소로부터 보호받고 있다는 것이 실험적으로 규명되었다. 간암의 경우 간 자체의 동반 병변으로 인해 독성 부담이 우려되는 ADC 등의 치료법 적용이 용이하지 않은 상황에서 AST-201은 그 대안이 될 수 있을 것으로 여겨진다.
② 적응증 확장 가능성
AST-201은 GPC3-양성 암종을 표적으로 한 ApDC다. 따라서 GPC3-양성률이 높은 폐암, 두경부암으로의 적응증 확대 가능성은 매우 높다. 두 암종은 젬시타빈이 병용요법의 치료제로 사용되고 있어, AST-201에 의한 젬시타빈의 표적 전달은 치료 효과를 한층 높이면서 부작용은 최소화시킬 수 있는 효과적인 전략이 될 수 있을 것으로 판단된다.
현재 세포 수준의 항암 선택성을 확인한 이후 폐암에 대한 이종이식 동물모델에서의 항암 유효성 확인 연구가 진행 중이며, 다양한 암종으로의 적응증 확대를 순차적으로 진행할 계획이다.
약물의 효능
① 종양 선택적 암세포 사멸
GPC3-양성과 GPC3-음성 세포주를 이용한 선택적 세포사멸 평가를 통해 GPC3-양성에 대한 종양 선택성과 특이성이 입증됐다.
② 이종이식 마우스 모델에서의 항암 유효성
간암 세포주 HepG2를 이용한 이종이식 마우스 모델에서 종양 성장 억제효과가 확인됐다. 주 2회 투여만으로 대조군으로 매일 투여된 간암 표준치료제 소라페닙 대비 우수한 종양 억제 효과를 확인했고, 3주 투여 종료 후 회복 기간에도 지속적인 종양 억제 효과를 관찰할 수 있었다. 반면, 소라페닙 대조군에서는 회복 기간에 종양의 재성장이 관찰됐다.
우수한 종양 억제 효과와 더불어 투여 기간 및 회복 기간 중 독성으로 인한 체중 감소나 혈액 및 조직학적 부작용 또한 관찰되지 않아 표준치료제인 소라페닙 대비 안전성과 우위성을 확인했다. AST-201은 내년 임상 진입을 목표로 GMP 임상시료 생산을 위한 CDMO 계약을 준비하고 있다.

*이 기사는 <한경바이오인사이트> 매거진 2021년 10월호에 실렸습니다.