개발 배경
전립선암 진단·치료 방사성의약품은 방사성동위원소를 사용해 전립선암에만 특이적으로 발현되는 PSMA 단백질을 타깃해 암세포를 추적 관찰하거나 파괴하는 표적 조영제 및 치료제다.
PSMA는 전립선암 환자의 약 90%에서 발현되며 정상세포에서는 거의 발현되지 않아 질병의 바이오마커로 사용이 가능하다. 반감기가 110분인 F18(플루오린) 동위원소를 PSMA와 결합해 환자에게 투여하게 되면 동위원소에서 방출되는 양전자 에너지를 PET/CT가 영상화해 전립선암의 분포와 크기에 대한 정보를 얻을 수 있다. 루테튬(177Lutetium), 또는 악티늄(Ac225) 등의 강력한 방사선을 방출하는 동위원소를 결합하게 되면 전립선암세포를 선택적으로 표적 치료할 수 있다.
진단과 치료 역할은 방사성동위원소가 그 역할을 담당하며 PSMA와 유사한 분자구조를 가진 펩타이드는 캐리어 역할로 암세포까지 찾아가는 역할만 수행한다. 핵심기술은 동위원소와 펩타이드의 결합력을 높여 병소에 예상된 투여량이 잘 흡착될 수 있도록 하는 동위원소 표지 기술(labeling tech)과 질병 내 발현되는 펩타이드의 분자구조와 가장 잘 결합하는 화합물의 형태로 제조하는 것이다. 병소에만 국한해 결합되고 다른 장기에는 거의 흡수되지 않으며 빠른 신장 클리어런스를 보이는 화합물(펩타이드) 제조 기술이다.
생산 측면에서는 방사능 피폭의 위험이 있어 방사선과 관련된 인허가를 요구하고 차폐된 시설(핫셀)에서 자동으로 합성·정제·제제 등을 할 수 있는 GMP 수준의 제조 설비를 구축해야 한다는 특성이 있다.
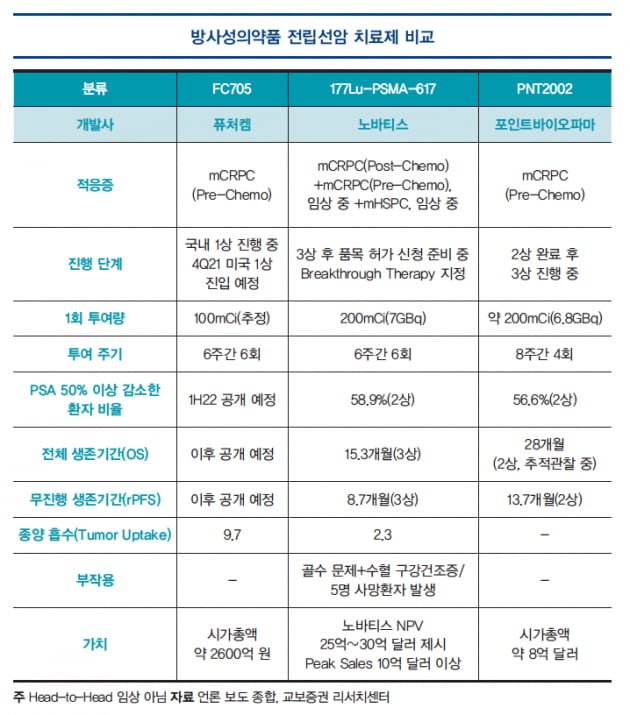
퓨쳐켐은 진단제로 FC303을, 치료제로 FC705를 개발 중이며, 진단제로서 경쟁물질은 미국 란테어스홀딩스의 ‘DCFPYL’이 있다. 치료제로는 노바티스 계열회사인 AAA의 ‘177Lu-PSMA-617’이 임상 3상을 마치고 품목허가를 준비 중이다.
약물 개발의 의미
FC303과 전립선암 치료용 방사성의약품 FC705는 전립선암에만 특이적으로 발현되는 단백질인 PSMA(Prostate Specific Membrane Antigen)를 선택적으로 표적하는 화합물이다.
전립선암 발생률은 미국에서 1위, 국내에서도 4위로 빠르게 증가하는 추세지만 치료의 옵션이 다양하지 않은 상황이다. 현재 전립선암의 치료는 PSA(전립선특이항원) 혈액검사, 직장수지검사, 직장초음파검사를 통해 특이점이 의심되는 부분을 확인한 뒤 이뤄진다. 또는 MRI나 CT를 통해 전립선암의 전이 여부 및 전이 정도를 파악해 절제, 호르몬 치료, 방사선 치료 등을 진행한다.
기존 진단 방법들인 조직검사는 침습적인 방법으로 환자 편의성이 떨어지고, PSA 혈액진단과 MRI 검사는 정확도가 각각 30%, 60~80% 정도로 높지 않은 상황이다. 또 전립선암은 뼈, 근육 등 온몸에 전이가 되는 특성을 가지고 있으며 호르몬 치료가 더 이상 듣지 않는 mCRPC(전이성 거세저항성 전립선암)로 발전하기 쉽다.
퓨쳐켐의 FC705는 완치가 불가능한 기존 치료법과는 달리 미세한 암까지 표적하고 정상세포 및 장기 손상이 거의 없이 mCRPC 치료의 새로운 치료법을 제시한다.
전립선암 진단제 FC303과 치료제 FC705를 활용하면 진단과 동시에 병변 부위에만 치료를 할 수 있는 테라노스틱스를 달성할 수 있을 것으로 기대된다. 퓨쳐켐은 전립선암 치료제뿐만 아니라 전립선암 진단제도 동시에 개발하고 있다. FC303과 FC705의 화학구조가 비슷하기 때문에 FC303을 통해 FC705 치료의 진단부터 치료 후 추적 관찰까지의 종합적인 전립선암 치료 솔루션을 제시하며 진단제와 치료제로의 시너지 효과를 낼 것으로 전망된다.
효능
노바티스는 2017년 전립선암 치료제인 PSMA-R2의 임상 1상을 진행 중이던 AAA를 39억 달러에 인수했으며, 1년 뒤인 2018년에는 PSMA-R2보다 더 효능이 좋다고 알려진 PSMA-617을 개발 중이던 엔도사이트를 21억 달러에 인수했다.
경쟁물질인 노바티스의 PSMA-617이 올해 6월 미국 임상종양학회(ASCO)에서 발표한 임상 3상 결과는 무진행생존 중앙값이 표준 치료법에 비해 사망위험이 60% 감소할 정도로 신약으로서의 허가 가능성을 보였다. 또 최근 미국 FDA로부터 혁신 치료신약으로 지정되어 품목허가 기간을 단축하고 허가 가능성이 매우 높은 상태다.
하지만 PSMA-617 치료는 일반 호르몬 치료나 항암 치료에 비해 더 높은 부작용이 확인됐다.
PSMA 단백질이 발현되는 정상세포가 일반적으로 골수, 눈물샘, 침샘 및 신장에서도 발현돼 안구건조증, 침샘마름현상, 피로감 등의 부작용이 발생한다.
FC705는 베타선을 이용해 종양을 표적 치료하며, 경쟁물질인 1세대 물질과 달리 혈액 내 다량 함유돼 있는 단백질인 알부민에 결합할 수 있는 ‘알부민 바인더’를 탑재했다. 혈액 내 잔류시간을 크게 증대시켜 전임상에서 치료 효능 평가 결과 소량의 투여로도 높은 치료효과를 확인했다.
전임상 결과 FC705는 경쟁물질 대비 암세포에 대한 적중률이 높고, 종양에 섭취 후 장기간 지속적인 치료 효과를 가진다. 정상장기에서의 방사성 피폭량은 적은 것으로 확인됐다. 타사의 경쟁물질 대비 적은 용량 투여로 우수한 치료 효과와 낮은 부작용을 기대하고 있다.
임상 단계
현재 FC705는 국내에서 임상 1상을 진행 중에 있으며 미국 임상은 연내 FDA에 임상 1·2a상을 동시에 신청할 예정이다. 국내에서는 전이성 거세저항성 전립선암 환자 30명을 6명씩 5개 그룹으로 나눠 안정성 및 유효성을 평가하고 있다.
낮은 투여용량부터 높은 투여용량(50mCi, 75mCi, 100mCi, 125mCi, 150mCi)으로 순차적으로 용량을 증가하면서 투여 후 일정기간 추적 관찰을 할 예정이다. 현재 3번째 환자군(100mCi)까지 투여 완료했고 연내 모든 환자의 투여를 마치고 적정 용량을 확정지을 예정이다.
현재 임상 단계에서 퓨쳐켐의 FC705의 투여 용량은 100mCi(밀리퀴리)로 정해질 것으로 예상되고 있으며, 경쟁물질인 PSMA-617의 투여용량인 200mCi 대비 절반수준의 용량이다. 2배 이상의 표준섭취계수(SUV) 값과 종양을 제외한 정상세포에서의 피폭 부작용도 현저히 낮을 것으로 기대한다.
적응증 등 활용 가능성
경쟁제품인 노바티스의 PSMA-617은 전이성 거세저항성 전립선암(mCRPC) 환자를 대상으로 한 임상 3상 시험을 완료하고 연내 품목허가 가능성이 있다. 또 노바티스는 PSMA-617의 처방 가능 환자를 확대하기 위해 화학항암제 투여 전 환자(Pre-taxane)와 호르몬 반응성 전이성 환자(mHSPC) 대상 임상을 추가로 신청했다.
퓨쳐켐도 현재 mCRPC 환자를 대상으로 임상 1상을 진행 중에 있으며, 앞으로 초기 환자로의 적응증을 확대해나갈 계획이다. 방사성동위원소 치료제는 실제 임상시험 시 환자 선정에서부터 치료 효과를 알기 위해 PET 진단용 방사성의약품이 반드시 필요한 특성이 있어 방사성 리간드(Radio Ligand) 진단제를 보유하느냐가 중요하다.
퓨쳐켐은 플루오린 기반 전립선암 진단제인 FC303을 자체 개발해 임상 진행 중에 있으며, 환자 치료의 편의성 및 비용효율성을 높일 수 있을 것으로 기대한다.
*이 기사는 <한경바이오인사이트> 매거진 2021년 10월호에 실렸습니다.