동정적 사용은 생명을 위협하거나 중증 질환의 적절한 치료 대안이 없을 경우, 개발 중이나 아직 판매허가를 취득하지 못한 신약의 사용을 승인해 치료의 기회를 주는 FDA의 제도다.
엔케이맥스는 현재 미국에서 진행 중인 불응성 고형암 임상 1상에서 SNK01·키트루다 병용의 가능성을 확인하고 동정적 사용을 승인받았다는 설명이다. 이번 결과는 육종암의 일종인 결합조직성소원형세포종(DSRCT) 환자에게 병용요법을 적용한 것이다.
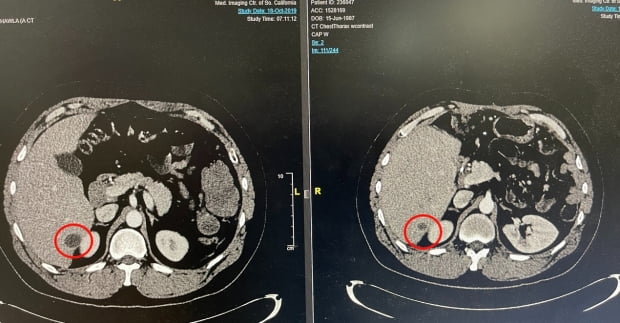
이 환자는 2017년 육종암을 판정받은 32세 남성이다. 약 1년 반 동안 기존 화학요법으로 치료를 진행했으나 암세포가 줄어들지 않고 독성이 나타났다. 이후 키트루다를 추가로 투여받았지만 지속적으로 암이 커져 16주기에 치료가 중단됐다.
이후 동정적 사용 환자로 등록돼 2년 간 SNK01·키트루다 병용 투여를 받았다. 그 결과 2019년부터 2021년 11월 현재까지 간에 발생한 암의 약 78%가 감소했다는 것이다.
육종암은 기존 화학치료로는 변화가 없으며, 면역관문억제제인 바벤시오와 임핀지의 각 임상에서도 치료반응률 0%를 기록한 악성 종양이라고 회사 측은 전했다. 미국에서는 발병 환자 20만명 미만으로 희귀암으로 지정돼 있다.
박상우 엔케이맥스 대표는 "이번 동정적 사용 결과는 약물의 우수성 확인은 물론, FDA의 희귀의약품 지정 과정에서도 매우 귀중한 자료로 사용될 수 있을 것"이라며 "미충족 의료수요가 높은 육종암 분야에서 가장 먼저 FDA 허가 및 상용화를 목표로 개발에 박차를 가할 계획"이라고 말했다.
한민수 기자









