
후천성 면역세포도 이와 같이 태어난 고향(골수와 흉선)을 떠나 학교(림프절)에서 교육을 받고 세상(조직)으로 나가 각자의 길을 가게 된다.
처음엔 다들 비슷한 면역세포 클론으로 태어났으나 사람처럼 학교에서 어떤 교육을 받는 지에 따라 다양한 성격과 능력을 얻게 되고, 세상이라는 풍파를 만나면 그곳에 잘 적응해서 존재를 증명해야 한다.
면역반응의 재구성 ① 선천성 면역과 후천성 면역의 연결
후천성 면역반응이 어떻게 작동하는지 코로나19 바이러스 감염을 예로 면역반응을 재구성해본다.
코로나19 바이러스가 호흡기를 통해 들어오면 바이러스는 증식을 위해 우리 세포 안으로 침입한다. 세포 안으로 들어온 바이러스는 유전물질인 리보핵산(RNA)을 세포질로 내보내고 세포의 유기물을 사용해 RNA를 복제하고 바이러스 단백질들을 만든다. RNA와 단백질이 다시 합쳐져서 새로운 바이러스 입자들이 되고 세포 밖으로 나와 다른 세포로 침입한다.
면역반응은 감염균이 침입한 조직 최전선에서 시작한다. 바이러스가 침투한 상피세포나 모든 조직의 보안관 역할을 한다고 했던 대식 세포(macrophage)들은 바이러스를 포식 (phagocytosis)하고 곧 감염균의 분자패턴(PAMP·Pathogen-Associated Molecular Pattern)을 인식해서 강한 선천성 면역반응을 일으킨다.
그렇다면 코로나19 바이러스의 경우 선천성 면역을 활성화하는 패턴은 무엇일까. 세균과 달리 세포벽을 둘러싼 외피 같은 물질이 없는 바이러스들은 놀랍게도 유전물질 RNA가 PAMP로 작용한다고 했다. 바이러스 RNA가 인간 세포의 RNA와 거의 유사하지만, 일부 미세구조가 다르고 세포 안에 위치하는 장소가 달라서, 이를 세포의 형태인식수용체(PRR·Pattern Recognition Receptor)가 인식해서 반응한다.
조직 염증반응의 시작은 이미 지난 연재에서 다뤘지만 간단히 다시 정리한다. PAMP-PRR 반응은 상피세포들에서는 주로 인터페론(interferon)이라는 항바이러스 물질의 분비를 유도한다. 또한, 조직에 거주하는 대식 세포들은 대표적인 염증 유도 사이토카인인 인터루킨-6(IL-6), TNF-알파(Tumo r Necrosis Factor-α), 인터루킨-베타(IL-1β) 등을 분비한다. 이러한 폐 조직의 염증 유도는 선천성 면역반응을 조기에 증폭시켜 바이러스를 제압하고자 함이 목적이다.
따라서 염증성 물질들은 혈관을 통해 지원군들을 불러오고, 이들 중에는 바이러스 감염 세포를 직접 죽일 수 있는 자연살해(NK) 세포와 조직 내 염증반응을 유지하는 호중구(neutrophil), 단핵구(monocyte) 같은 세포들이 포함된다.
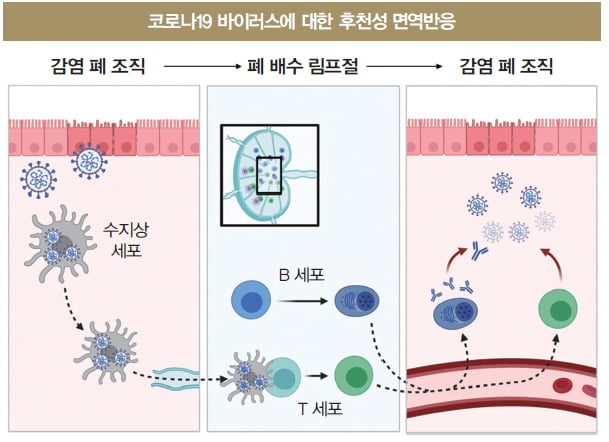
이때 후천성 면역세포들은 어디에서 뭘 하고 있을까. 본격적으로 전투에 참여하기 위해 폐 근처 림프절에서 전열을 가다듬고 준비 중이다. 증식한 코로나19 바이러스에서 유래한 항원이 폐 조직의 체액으로 나와 주변의 림프관 (물길)으로 흘러들어 근처의 가장 가까운 림프절(댐)에 모인다.
후천성 면역세포들인 T세포와 B세포들은 림프절의 특정 부위에서 항원을 설레는 마음으로 기다린다. 기억하겠지만 이들 후천성 세포들은 각각 개별적인 수용체를 무작위적으로 가진 클론들로 구성되므로, 이들 중 누가 바이러스 항원과 궁합이 맞을지 알기 어렵다.
B세포는 항원을 수용체(항체)로 직접 볼 수 있으므로 림프절의 가장자리(B-cell follicle)에서 흘러온 코로나19 항원을 수용체로 직접 보기 시작한다.
반면 T세포는 바이러스 항원이 잘려 MHC 분자에 올라왔을 때만 반응할 수 있다. 따라서 전문적 항원 제시 세포인 수지상 세포(dendritic cell)가 바이러스 항원을 폐 조직으로부터 가지고 와서 림프절의 T세포가 모여 있는 곳(T-cell area)으로 이동해서 항원을 MHC와 함께 제시하면 수많은 T세포가 몰려와 수용체(TCR)로 항원(pMHC)을 스캔한다. 드디어 후천성 면역반응이 기세를 올리는 장면이다.
수많은 T세포 클론 중 항원 반응성(TCR-pMHC 사이의 결합력)이 큰 클론들이 선택되어 증 식 하 고 이를 클론 선택(clonal selection) 과정이라고 했다. 인간 개개인의 MHC는 다형적(polymorphic)이고 TCR은 무작위적(stochastic)으로 발생하는 것이라 클론 선택 과정은 엄밀히 얘기하면 개인마다 특화된 과정이다. 그럼에도, TCR의 광범위한 다양성은 항원에 최선 혹은 차선으로 반응하는 클론이 선택되도록 할 것이다.
보통 림프절에서 클론이 선택되어 그 수를 증식하는 데 약 3~5일의 시간이 필요하다. 림프구의 증식이 때론 매우 강력해서 급성 감염과 같이 강한 면역반응이 유도되는 경우 특정 클론 수가 수백 또는 수천 배로 늘기도 한다.
즉 코로나19 항원에 반응할 수 있는 같은 면역수용체를 가진 클론들이 불어난다는 것을 의미한다. 그 정도로 림프구의 수가 늘어나므로 림프절 크기가 커져서 손으로 만져지는 정도가 되는 것이다.
클론 선택은 B세포 및 T세포에서 비슷하게 일어난다. 항원 미접촉(naive) 세포들이 항원을 나름의 방식으로 보는 과정이 있고, 이후 항원을 가장 잘 볼 수 있는 클론들만 그 수가 증식하는 형태다. 하지만 후천성 면역반응의 질적인 변화에는 CD4+ 도움 T세포(TH cell)의 역할이 크다.
TH세포는 클론 선택 과정에서 그 수를 늘림과 동시에 특별한 기능을 수행할 수 있는 계통(TH lineage : TH1·TH2·TH17·Treg 등)으로 분화한다고 했다. 코로나19의 경우 감염된 세포의 제거가 직접적인 염증의 해소 방안이므로 세포 살상에 도움을 줄 수 있는 형태인 TH1 세포로 분화한다.
이렇게 TH세포 분화를 교육하는 건 폐 조직에서 코로나19 감염의 정보를 가져와 항원과 함께 제시하는 수지상세포의 역할이다. 분화한 TH1세포 중 일부는 클론 선택으로 수를 불린 B세포의 질적인 변화를 유도하는 데 이들을 ‘여포 보조 T세포(TFH·Follicular Helper T)’라고 부른다.
B세포의 질적 변화는 곧 이들이 분비하는 항체의 질적인 기능 향상을 의미하고, 이는 항원 친화력(affinity)의 증가와 항체 작용성(effector function)의 향상으로 이뤄진다. 조직에서 흘러온 항원에 의해 일차 클론 선택된 B세포들은 아직 골수에서 나올 때 만들어진 IgM 항체를 세포 표면에 갖고 있다.
비록 코로나19 항원에 잘 들어맞는 IgM을 가진 B세포들이 선택됐지만, 이 항체로 바이러스를 제압하기엔 그 친화력이 낮아서 최대한 끌어올려야 한다.
또한, 항체의 기능을 담당하는 Fc 부위가 IgM의 경우 항바이러스 역할을 하기 어려운 점이 많다. IgM 항체는 NK세포를 활성화하기도 어렵고, 폐 조직으로 침투하는 것도 구조적인 제약이 있다. 따라서 코로나19를 상대하기 위해 더 유리한 IgG나 IgA의 형태로 동형 전환(isotype switching)이 필요하다. 이런 B세포의 질적 변화에 TFH세포가 결정적인 역할을 하는데, 바로 후천성 면역의 가장 우아한 반응인 배 중심(GC·Germinal Center)을 통해서다.
영화 <여인의 향기>에서 극 중 시각장애인으로 분한 알 파치노가 젊은 여성을 리드하면서 탱고를 추는 명장면이 나온다. 본인의 실수로 탱고가 꼬이면 어떡하느냐는 여성의 우려에 알 파치노는 “꼬이면 꼬인 대로 추는 게 탱고죠(If you tangled up just tango on)”라는 대사가 인상 깊었다. TFH세포가 B세포와 만나서 이후 림프절을 가로지르며 이동하면서 GC를 만드는 과정은 마치 두 사람이 서로에 기대어 탱고를 추는 모습과 비슷하다.
GC 반응에서 TFH가 알 파치노의 역할로, B세포가 이후 새로운 항체를 만드는 결정적 역할을 한다. 항원 미접촉 B세포 및 T세포가 림프절 각자의 공간에서 항원을 보고 클론 선택된 TFH, BIgM(독자의 이해를 위해 표면 항체 타입을 표기한 것으로 실제로 이렇게 표기하진 않는다)은 먼저 B세포와 T세포 구역의 경계(T-B border)로 이동해서 서로 친족(cognate)임을 확인한다.
즉 같은 항원에 의해 클론 선택된 B세포와 T세포들이 만난다는 의미로, B세포도 항원제 시세포의 일종으로 TFH가 수지상세포에 의해 자극되는 것처럼 동일한 pMHC를 제시할 수 있기 때문에 가능한 일이다. 친족임을 확인한 T·B세포는 쌍(cognate pair)이 되어 탱고를 시작한다.
이들은 먼저 림프절의 medullar 지역으로 이동하고, BIgM세포는 항체를 분비할 수 있는 형질세포(plasma cell)로 변신해 IgM을 다량 생산한다. 우리가 항원에 노출됐을 때 가장 먼저 IgM 항체가 혈청에서 관찰되는 이유가 바로 이 때문이다. 항체의 기능은 좀 떨어지더라도 고기능 항체로의 변신에 대략 일주일 이상의 시간이 필요하므로 그사이에 감염균에 대항하는 일차 대응 항체의 역할이 필요하다고 이해하면 된다.
이후 T·B세포 쌍은 다시 B세포 구역으로 이 동해서 본격적으로 GC를 구성한다. TFH세포가 주는 도움 신호들은 이동한 BIgM세포에서 더 이상 IgM 항체를 만들지 않도록 하고 동시에 항체의 항원 친화력에 중요한 가변부위에 의도적인 돌연변이가 발생하게 한다(체세포 과돌연변이, somatic hypermutation 과정이라 부른다). 그리고 항체의 동형은 IgM에서 다른 형으로 변화한다.
지금 우리는 코로나19 바이러스 상황을 얘기하고 있고 바이러스에 대항하기 위해 분화된 TH1세포에서 TFH가 파생됐음을 기억하자. 따라서 항바이러스 기능이 높은 IgG나 폐 점막으로 분비될 수 있는 IgA 동형으로 전환된다. 즉 TFH세포의 도움 신호로 BIgM세포가 BIgG 혹은 BIgA 세포로 변신하는 것이다.
가변부위에 축적된 돌연변이는 무작위적인 반응으로 항체가 코로나19 항원에 결합하는 친화력을 높일 수도 혹은 낮출 수도 있다. 이들 중 친화력이 높은 B세포 클론들만 선택적으로 살아 남는데, 이는 제한된 코로나19 항원에 높은 친화력을 갖는 항체를 가진 B세포들만 세포 생존 신호를 받을 수 있기 때문이다.
이 과정이 B세포가 특정 방향이 없는 돌연변이를 통해 주어진 항원에 더 나은 적합성(fitness)을 얻는 클론만 선택되므로, 마치 다윈의 자연 선택(natural selection) 과정의 축소판이라 생각할 수 있다. 이렇게 항원 친화력과 기능성을 업그레이드한 새로운 항체를 가진 B세포는 최종적으로 형질세포가 되고 이들이 분비하는 항체(IgG 또는 IgA)가 기존 IgM 항체를 보완 혹은 대체한다.
면역반응의 재구성 ③ 후천성 면역세포의 작용
면역반응은 최초 선천성 면역의 형성부터 후천성 면역의 발전까지 하나의 회로로 연결돼 있다. 먼저 감염균의 항원과 조직 염증의 정보를 갖고 수지상세포가 근처 림프절로 이동한다. 림프절에서 적합한 TH세포 클론이 수지 상세포에 의해 선택 및 조련돼 특정 계통으로 분화한다.
반면 조직에서 흘러온 항원에 반응해서 클론 선택된 BIgM은 감염균이나 조직 염증의 정보는 제공되지 않는다. 하지만 이후 GC 반응을 통해 TFH세포가 BIgM에게 적절한 정보를 제공하고 고기능 항체를 분비하는 BIgG세포가 탄생한다.(수지상 세포→TH세포→BIgM세포로 염증 정보의 전달) T세포의 다른 종류인 세포 독성 T세포(CTL·Cytotoxic T Lymphocyte)도 빼놓을 수 없다.
항원 미접촉 CD8+ T세포 역시 림프절에서 수지상세포가 제공하는 pMHC에 의해 클론 선택된다. 이후 주변에서 같은 항원에 의해 선택된(즉 친족인) TH세포의 도움을 통해 강력한 세포 살상 기능을 가진 CTL로 분화한다.
이제 림프절에서 할 수 있는 모든 준비는 끝났다. 진화한 T세포 및 B세포들은 이 모든 과정의 시작인 염증(감염)을 해소하기 위해 폐로 이동한다. 림프관 물길은 한 방향으로만 흘러서 면역세포들이 물길을 거슬러 림프절에서 바로 폐로 이동할 순 없다.
대신 림프관을 따라가다 혈액과 만나고 혈류를 통해 폐 조직으로 들어간다. 조직으로 들어간 TH1 및 CTL 세포들은 조직 내 모든 자원을 가동해 코로나19 바이러스에 감염된 세포들을 제거한다. 여기서도 TH1세포는 지휘관이 돼서 대식세포의 항바이러스 기능을 올리고 NK 및 CTL과 같은 감염 세포 살해자(killer)들을 독려한다.
반면 B세포는 분화의 마지막 단계인 형질세포가 되면 고기능 항체를 세포 밖으로 분비하므로 구태여 폐 조직 안으로 들어갈 이유는 없다. 림프절에서 항체를 분비하는 경우가 대부분이지만, 일부 형질세포는 오랫동안 살 수 있는 세포가 돼 마치 연어처럼 태어난 고향인 골수로 회귀해 항체를 분비한다.
일부 B세포는 조직 근처에서 분화되어 형질 세포가 되기도 하는데, 이 경우 점막에서 주로 관찰되는 IgA 동형의 항체를 분비할 수 있다. 항체는 혈액을 돌다가 폐 조직 내부로 들어와 바이러스가 세포 내부로 침입하는 것을 막거나, 바이러스 입자를 대식세포나 수지상 세포에게 전달하거나, 감염된 세포 표면에 노출된 바이러스 단백질에 붙어 NK세포들을 유인해 감염 세포가 죽임을 당하도록 해서 바이러스 제거에 중요한 역할을 한다.
폐 조직에서 코로나19 바이러스를 제거하는 전투가 마무리되면 대부분의 작용 면역세포들은 세포사멸 과정을 통해 전장에서 사라진다. 이는 자연스러운 과정으로 특정 클론들이 활성이 높은 채로 많은 수가 존재하는 것은 감염이 해소된 이후엔 호스트에게 부담되는 일이다.
하지만 일부 세포는 특별한 상태로 오랜 기간 살아남아 전투를 기억하는 세포가 된다. 이들은 림프절에서 혹은 폐 조직에서 기억 T세포 또는 B세포가 되어 다음 라운드를 기다린다. 후천성 면역의 가장 중요한 특징인 면역 기억(immunological memory)이다.
<저자 소개>

바이러스면역학을 전공하고 포스텍에서 박사학위를 취득했다. 미국 샌디에이고 라호야면역학 연구소에서 박사후연구원을 마치고 2012년부터 포스텍 생명과학과 교수로 재직 중이다. 세포면역학 연구실을 운영하고 있으며, 기초연구로는 점막기관 염증 및 감염 면역을, 응용 연구로는 항암면역 치료를 연구 중이다.
*이 글은 <한경바이오인사이트> 매거진 2022년 1월호에 실렸습니다.









