
박사후연구원 과정을 밟기 위해 찾은 미국 국립보건원(NIH)의 이든 셰박 교수 연구실에서 사람의 조절T세포를 배양할 수 있는 기술을 확립한 뒤 사업화 방향을 찾다 미국 정부의 도움으로 현지에서 창업하게 됐다는 것이 김 대표의 설명이다.
조절T세포는 혈액에서 추출해 배양하면 세포독성T세포 등으로 변해버리는 특징이 있어 체외에서 배양하기가 어려운 면역세포 중 하나로 꼽힌다. 조절T세포를 이용한 세포치료제를 만들려는 과거 시도가 번번이 좌초됐던 것도 이 때문이다. 김 대표는 “혈우병 같은 자가면역질환을 조절T세포로 치료할 수 있겠다는 개념증명(POC)이 확고해지면서 창업을 결심했다”고 강조했다. 김 대표가 직접 수행한 관련 연구 결과는 2015년 저명한 국제학술지 <블러드>에 실렸다.
조절T세포로 자가면역질환 치료
테라이뮨의 첫 번째 후보물질(파이프라인)은 혈우병 치료제 TI-168이다. 이달 말 중 미국 식품의약국(FDA)에 임상 1상 시험계획(IND)을 제출한다는 계획이다.
혈우병은 출혈이 생기면 피가 굳지 않는 유전병이다. 혈중 내 피를 굳게 하는 단백질인 팩터VIII(FVIII)를 스스로 생산하지 못해서 생긴다. 외부에서 합성한 FVIII를 넣어줌으로써 증상을 개선할 수 있는데 문제는 혈우병 환자의 면역시스템이 FVIII를 외부항원으로 인식해 공격할 때 생긴다.
수지상세포가 혈중 내 FVIII를 포획한 뒤 주조직적합복합체(MHC)를 통해 T세포에 전달하면 T세포가 활성화되고, 후천면역을 담당하는 B세포도 함께 활성화된다. B세포는 FVIII를 인식하는 항체를 생산해 더 이상 체내 FVIII가 남아 있지 못하도록 한다. 활성화된 후천면역시스템이 혈우병 증상 개선을 위해 투여한 FVIII를 모조리 제거하는 것이다. 김 대표는 “사실상 백신이 유도하는 항원항체반응과 똑같다”고 덧붙였다.
TI-168은 FVIII를 인식하는 T세포의 수용체(TCR)를 조절T세포에 발현시킨 세포치료제다. 이른바 TCR-Treg(조절T세포)다. FVIII를 인식한 조절T세포(TI-168)가 B세포와 T세포를 억제한다. 특히 이 방법으로 B세포가 FVIII에 대한 항체를 생산하는 일을 막을 수 있다.
김 대표는 “자세한 억제기전은 아직 밝혀내지 못했으나 B세포 항체 생산 신호전달을 차단한다는 것은 동물실험을 통해 확인했다”고 말했다.
두 번째 후보물질 TI-235의 적응증은 또 다른 자가면역질환인 다발성 경화증(MS)이다. 면역세포가 뇌신경의 일부를 적(항원)으로 인식해 공격하는 질병이다. 신경을 감싸는 전선피복 역할을 하는 미엘린초(myelin sheath)가 면역세포에게 공격받아 발생한다. 그 결과, 미엘린초가 벗겨지고 신경신호를 전달하는 엑손이 밖으로 노출된다. 피복이 벗겨진 전선처럼 신경신호가 제대로 전달되지 않게 된다.
김 대표는 “대증요법을 쓰거나 방사선 치료로 후천면역을 비롯한 환자의 면역세포를 다 제거한 다음 골수를 이식해 면역체계를 ‘리셋’하는 것이 현존하는 유일한 치료법”이라며 “미엘린초에 있는 주요 단백질을 표적하는 TCR을 찾아 조절T세포에 이식한 세포치료제가 바로 TI-235”라고 설명했다. 테라이뮨은 내년 1월께 FDA에 TI-235에 대한 임상 1상 IND를 신청하겠다는 계획이다.
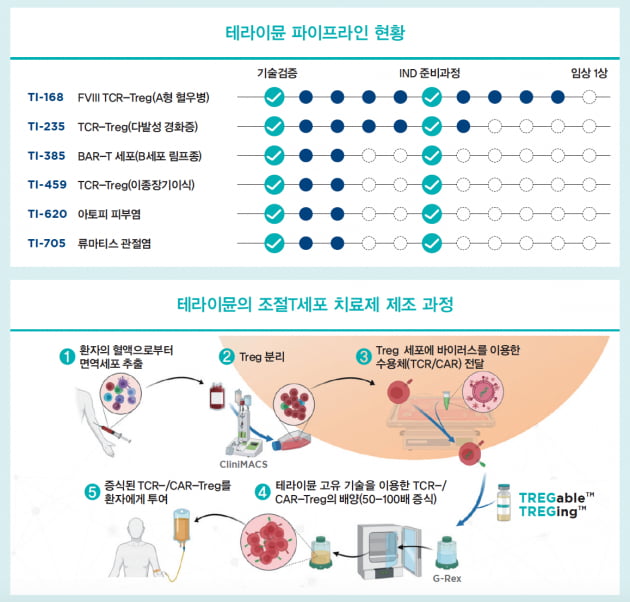
앞서 밝혔듯 조절T세포 기반 세포치료제 상용화를 막는 가장 큰 걸림돌은 바로 생산이다. 테라이뮨은 올리고뉴클레오티드를 이용해 조절T세포가 다른 T세포로 분화하지 않도록 성질을 유도하는 원천기술을 갖췄지만 일반적인 위탁생산(CMO) 업체에서도 높은 수율을 내줄지는 미지수다.
김 대표는 “지난해 4월부터 임상시험에 필요한 조절T세포를 생산하기 위한 GMP 시설을 메릴랜드주에 짓고 있다”고 말했다.
오는 5월 중 완공한 뒤 9월 개소가 목표다. GMP 시설 개소 전까지는 대형 CMO에 조절T세포 생산을 위탁하는 대신 일부 CMO 서비스를 하는 연구중심 병원을 통해 생산하겠다는 계획이다. FDA의 IND 승인이 나는 대로 오는 3분기부터는 혈우병 환자들에게 TI-168의 투약을 시작하겠다는 청사진도 공개했다. 김 대표는 “TI-168이 임상 1상에 진입하는 대로 빠른 기술수출(LO)을 할 수 있도록 사업개발(BD)팀도 가동을 시작했다”고 덧붙였다.
테라이뮨은 GMP 시설 구축과 임상 진입에 대비한 투자 유치도 시작했다. 설립 초기엔 김 대표의 고향인 한국에 있는 벤처캐피털(VC)의 도움을 많이 받았다.
새 투자 라운드에선 미국 시장을 목표로 하고 있는 만큼 현지 임상 및 마케팅을 위해 시리즈B부터는 미국 투자자들을 최대한 끌어오겠다는 계획이다. 여기엔 초기부터 테라이뮨에 투자한 국내 VC 네트워크의 힘을 빌리기로 했다.
김 대표는 “나스닥 상장 태스크포스(TF)를 조직해 기업공개(IPO) 채비를 해나갈 예정”이라며 “임상에 올라간 파이프라인 2개를 이용해 2024년 나스닥 상장, 그 이후엔 인수합병(M&A)에 대한 가능성도 열어두고 있다”고 말했다.
테라이뮨은 아르케인베스트먼트, 메디치인베스트먼트, DSC인베스트먼트 등 국내 VC 및 기타 투자자들로부터 111억 원 규모 시리즈A 투자금을 유치했다.

*이 기사는 <한경바이오인사이트> 매거진 2022년 1월호에 실렸습니다.










