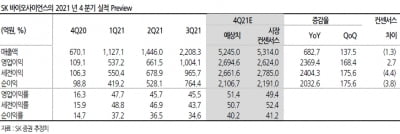
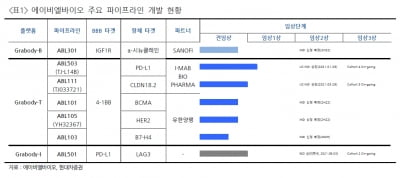
HLB테라퓨틱스, DIPG 치료에 대한 FDA ‘동정적 사용’ 승인
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
교모세포종 치료제 ‘OKN-007’
이명치료제에 이어 두 번째
이명치료제에 이어 두 번째
에이치엘비테라퓨틱스(옛 지트리비앤티)가 교모세포종 치료제로 개발하고 있는 ‘OKN-007’에 대해 미국 식품의약국(FDA)으로부터 산재적 내재성 뇌교종(DIPG) 소아 환자 치료를 위한 동정적 사용 승인을 받았다고 18일 밝혔다. 지난해 11월 청력 손실 및 이명치료 신약물질인 ‘NHPN-1010’이 동정적 사용승인을 받은 데 이어 두 번째다.
동정적 사용(Expanded Access Program)은 장기간 생명을 위협하거나 중증 환자에 대한 적절한 치료제가 없을 때, 아직 개발 중인 신약 치료제의 사용을 허가하는 제도다.
OKN-007은 에이치엘비테라퓨틱스의 미국 자회사 오블라토가 개발 중이다. 교모세포종(GBM) 환자를 대상으로 임상 2상을 진행하고 있다. 오블라토는 OKN-007이 교모세포종과 함께 산재적 내재성 뇌교종 동물 모델에서도 효능을 보임에 따라, 산재적 내재성 뇌교종 치료제로 적응증을 확대해갈 계획이다.
산재적 내재성 뇌교종은 소아의 뇌간에서 발생하는 희귀소아암으로, 아직 승인된 치료제가 없다. 보통 5~10세 사이의 어린아이에게서 발병한다. 균형감각 이상과 두통을 일으키며, 병세가 진행되면 음식을 삼키거나 말하는 것이 어려워진다. 심하면 시력을 잃기도 한다. 환자의 90%가 진단 후 24개월 이내에 사망하고 5년 이상 생존 확률이 1%에 불과한 중증 질환이다.
에이치엘비테라퓨틱스는 동정적 사용 승인 후 첫 약물 투여를 시작했다. 약물 투여는 미국 오클라호마 대학 어린이병원 전문의인 맥널 박사 제안으로 이뤄졌다. 재발성 산재적 내재성 뇌교종 환자를 대상으로 지난달 첫 투약을 했고, 1개월 동안 특별한 부작용이 관찰되지 않았다는 설명이다. 이달 중 두 번째 환자의 투여를 시작할 예정이다.
안기홍 에이치엘비테라퓨틱스 대표는 “FDA의 동정적 사용 승인으로 항암신약 후보물질 OKN-007을 교모세포종에 이어 산재적 내재성 뇌교종으로 확대할 수 있는 가능성이 확인됐다”며 “환자 투여를 통해 추가적으로 데이터를 축적하고 치료 효과를 검증해 갈 것”이라고 말했다.
김예나 기자
동정적 사용(Expanded Access Program)은 장기간 생명을 위협하거나 중증 환자에 대한 적절한 치료제가 없을 때, 아직 개발 중인 신약 치료제의 사용을 허가하는 제도다.
OKN-007은 에이치엘비테라퓨틱스의 미국 자회사 오블라토가 개발 중이다. 교모세포종(GBM) 환자를 대상으로 임상 2상을 진행하고 있다. 오블라토는 OKN-007이 교모세포종과 함께 산재적 내재성 뇌교종 동물 모델에서도 효능을 보임에 따라, 산재적 내재성 뇌교종 치료제로 적응증을 확대해갈 계획이다.
산재적 내재성 뇌교종은 소아의 뇌간에서 발생하는 희귀소아암으로, 아직 승인된 치료제가 없다. 보통 5~10세 사이의 어린아이에게서 발병한다. 균형감각 이상과 두통을 일으키며, 병세가 진행되면 음식을 삼키거나 말하는 것이 어려워진다. 심하면 시력을 잃기도 한다. 환자의 90%가 진단 후 24개월 이내에 사망하고 5년 이상 생존 확률이 1%에 불과한 중증 질환이다.
에이치엘비테라퓨틱스는 동정적 사용 승인 후 첫 약물 투여를 시작했다. 약물 투여는 미국 오클라호마 대학 어린이병원 전문의인 맥널 박사 제안으로 이뤄졌다. 재발성 산재적 내재성 뇌교종 환자를 대상으로 지난달 첫 투약을 했고, 1개월 동안 특별한 부작용이 관찰되지 않았다는 설명이다. 이달 중 두 번째 환자의 투여를 시작할 예정이다.
안기홍 에이치엘비테라퓨틱스 대표는 “FDA의 동정적 사용 승인으로 항암신약 후보물질 OKN-007을 교모세포종에 이어 산재적 내재성 뇌교종으로 확대할 수 있는 가능성이 확인됐다”며 “환자 투여를 통해 추가적으로 데이터를 축적하고 치료 효과를 검증해 갈 것”이라고 말했다.
김예나 기자