메지온, 신약 유데나필 美 FDA 심사 지연 소식에 이틀째 '下'
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
미 FDA 허가가 불발 …유의성 지적

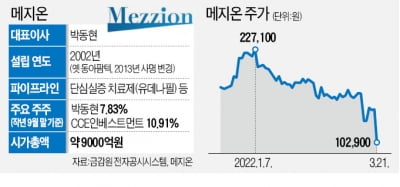
22일 오전 9시42분 현재 코스닥시장에서 메지온은 전 거래일 보다 3만800원(29.93%) 내린 7만2100원에 거래되고 있다. 메지온은 전날에도 하한가로 거래를 마쳤다.
앞서 메지온은 전날 단심실증 환자의 운동능력 등을 개선하는 의약품 '유데나필'의 미 FDA 허가가 불발됐다고 밝혔다.
메지온에 따르면 FDA는 메지온이 제출한 품목허가 신청서 1차 지표의 통계적 유의성에 문제가 있다고 지적했다. 이는 이 회사가 2016년 FDA에 제출한 임상 프로토콜에 근거해 판단한 것이다.
이 회사는 일정 수준 이상의 운동 능력을 가진 '슈퍼 폰탄'을 제외한 환자군에 대해 새로 분석을 실시했으나, 이 내용은 사후 분석이어서 규정상 승인 여부를 판단하는 근거로 사용하기 어렵다는 것이 FDA의 입장이다.
류은혁 한경닷컴 기자 ehryu@hankyung.com



![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


