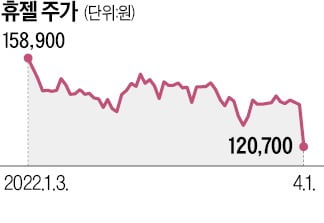
퓨쳐켐 물질, 절반 용량으로 우수한 효능 확인
오는 7월 국내 1상 최종보고서 수령 예정
1일 업계에 따르면 노바티스는 지난 23일(미국 시간) 플루빅토가 ‘PSMA’ 양성 전이성 거세저항성 전립선암(mCRPC)을 대상으로 FDA의 승인 받았다. 이 약물은 퓨쳐켐이 개발 중인 전립선암 치료제 ‘FC705’의 경쟁 약물이자 선도 약물이다.
플루빅토는 표적 방사성 리간드 치료제로, 암세포를 인지하는 리간드에 방사선을 내뿜는 방사성 동위원소 ‘루테튬 177’을 붙인 약물이다. 혈류를 따라 흐르다가 암세포에 달라붙은 뒤, 루테튬 177이 방사선을 내뿜어 암세포를 사멸시키는 원리다. 전립선암 환자 80%에서 발견되는 세포막 단백질 ‘PSMA’를 표적으로 방사성 동위원소를 전달해, 세포를 손상시켜 복제를 막고 세포 사멸을 유도한다.
노바티스가 지난해 6월 미국 임상종양학회(ASCO)에서 발표한 임상 3상(VISION) 결과에 따르면 플루빅토는 표준 치료에 비해 환자의 사망 위험을 38% 감소시켰다. 무진행생존기간(PFS)은 8.7개월로, 표준 치료를 받은 환자 평균 3.4개월에 비해 2배 이상 긴 것으로 나타났다. 전체 생존기간(OS)도 표준 치료에 비해 4개월 더 길었다.
현재까지 승인된 mCRPC 방사성 리간드 치료제는 독일 바이엘의 ‘조피고’와 플루빅토 두 가지다. 조피고는 내장 전이는 없지만 골 전이된 mCRPC 환자를 대상으로 2013년 FDA와 유럽의약품청(EMA)의 판매 승인을 받았다.
조피고가 골 조직 전이에 제한된 약물인 반면, 플루빅토는 내장을 포함해 체내 다른 부위로 전이된 mCRPC 환자에게도 활용할 수 있도록 개발됐다. 사실상 mCRPC 환자에 쓸 수 있는 최초의 방사성 리간드 신약으로 평가되고 있다는 설명이다.
업계 관계자는 “플루빅토는 전립선암 치료제의 게임체인저가 될 것”이라며 “기존 호르몬 요법 중 카바지탁셀 화학 치료요법과의 비교 임상 결과에서 유효성 지표를 모두 만족해, 표준 치료제로 자리잡을 가능성이 크다”고 말했다.
퓨쳐켐 “7월 FC705 국내 1상 종료…이달 美 1·2a상 신청”
국내에서는 퓨쳐켐이 전립선암 치료제로 FC705를 개발하고 있다. 퓨쳐켐은 FC705가 플루빅토의 절반 용량으로 동등 이상의 치료 효과를 내면서, 방사선 리간드 전립선암 치료제의 계열내 최고 신약이 될 것으로 기대하고 있다.회사는 이달 1상 마지막 환자에 대한 투약을 마칠 예정이다. 1상은 서울성모병원에서 mCRPC 환자 중 기존 1차 치료인 호르몬억제제를 투여 받고, 2차 치료로 화학요법 항암제를 투여 받거나 혹은 받지 않은 환자 30명을 대상으로 진행 중이다. 환자를 6명씩 5개 그룹으로 나눠 용량을 50~150밀리큐리(mCi)를 순차적으로 투여하면서, 8주간 안정성과 유효성 평가 및 적절한 용량을 결정하기 위한 임상이다.
퓨쳐켐은 지난해 11월 100mCi까지 투여를 마친 환자 그룹과 125mCi 투여를 진행 중인 환자 그룹에 대한 1상 중간 결과를 발표했다. 회사에 따르면 FC705 투여 환자의 최대 92%에서 전립선암 지표인 ‘혈청전립선특이항원(PSA)’이 감소하는 높은 치료 효과를 확인했다. 특히 100mCi 투여한 환자 6명 중 3명의 대상자에서 PSA 수치는 50% 이상 감소했다.
노바티스의 플루빅토 투여량의 절반에 불과한 용량에서 90% 수준의 감소율을 확인했다는 것이다. 플루빅토는 200mCi를 6주 간격으로 최대 6회 투여해, 58.9%의 PSA 감소율을 보였다.
퓨쳐켐 관계자는 “방사성 동위원소와 펩타이드의 결합력을 높이는 동위원소 표지 기술(Labeling tech)과 PSMA의 분자구조와 가장 최적화된 화합물의 형태로 제조해 병변에만 붙고 다른 장기에는 거의 섭취되지 않는 펩타이드 제조 기술을 갖고 있다”며 “또 혈중 단백질인 ‘알부민’을 표적하는 구조를 추가하는 등 체내 지속성을 개선해 경쟁물질보다 적은 투여량으로 효능을 높일 수 있다”고 설명했다. 또 낮은 투여량으로 부작용도 줄일 수 있을 것으로 기대했다.
퓨쳐켐은 이달에 임상 1상의 마지막 고용량(150mCi)에 대한 투약을 마치고, 8주 간의 관찰을 통해 오는 7월께 최종 결과보고서를 수령할 것으로 예상하고 있다.
최종 결과보고서에는 고용량 결과가 포함될 예정이다. 저용량에서 부분관해(PR) 또는 안전병변(SD) 상태를 확인했기 때문에, 고용량 결과가 포함될 1상 최종 결과는 더욱 고무적일 것으로 업계는 보고있다.
2상에서도 치료 효과를 확인할 수 있을 것으로 기대했다. 퓨쳐켐은 지난 2월 식품의약품안전처에 FC705의 2상을 신청했다. 회사 관계자는 “2상은 반복투여로 진행되기 때문에 단일투여로 진행했던 1상에서보다 더 좋은 치료 효과를 낼 것“이라고 말했다. 이어 “이달 중 미국 1·2a상을 신청할 계획”이라고 말했다.
김예나 기자


![美 사업 불확실성 커진 휴젤, 주가 13% '주르륵' [한재영의 바이오 핫앤드콜드]](https://img.hankyung.com/photo/202204/01.29489891.3.png)