엔케이맥스 "육종암 말기 환자서 완전관해 확인"
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
'PD-L1' 음성 환자 대상
SNK01과 키트루다 병용 투여
SNK01과 키트루다 병용 투여
회사는 육종암의 일종인 결합조직성소원형세포종(DSRCT) 환자를 대상으로 미국 식품의약국(FDA)로부터 동정적 사용 승인을 받았다. 엔케이맥스의 자연살해(NK)세포 치료제 후보물질(SNK01)과 MSD의 키트루다를 병용해 치료를 진행했다.
이 환자는 2017년 육종암 판정 당시 간 폐 복부 방광 등 전신에 암이 전이된 상태였다. 슈퍼NK 투약 전 약 1년 반 동안 화학치료제 및 면역항암제를 투여했지만 독성 반응이 나타나고, 암이 계속 커져 치료를 중단했다.
특히 이 환자는 ‘PD-L1’ 발현이 음성이었다. 전체 암 환자 중 25~30%만이 PD-L1 양성 환자고, 70~75%는 PD-L1 음성으로 알려져 있다.
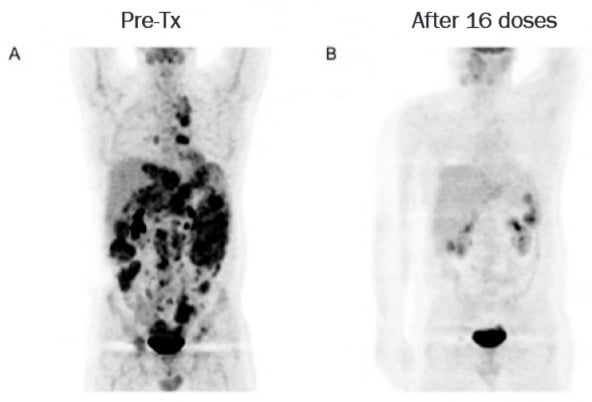
이 환자는 동정적 사용 환자로 등록돼 28개월 동안 총 30회에 걸쳐 SNK01과 키트루다를 병용 투여받았다. 양전자방출 컴퓨터단층촬영(PET-CT) 검사 결과, 잔존 종양이 존재하지 않는 것으로 관찰돼 CR 상태에 도달했다.
엔케이맥스는 지난해 12월 이 환자의 간에 발생한 종양이 약 80% 관해됐다고 공개했었다.
김혜련 연세암병원 종양내과 교수는 “PD-L1 발현이 거의 없는 음성 환자에게서 치료 반응을 보인 것은 드문 사례”며 “만약 SNK01이 PD-L1 음성 환자를 양성으로 변화시킬 수 있다면, 암 치료제 시장의 큰 변화를 이끌어낼 수 있을 것”이라고 말했다.
김예나 기자