크리스탈지노믹스, ASCO서 췌장암 미국 임상시험계획 발표
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
‘카페시타빈’과 병용요법
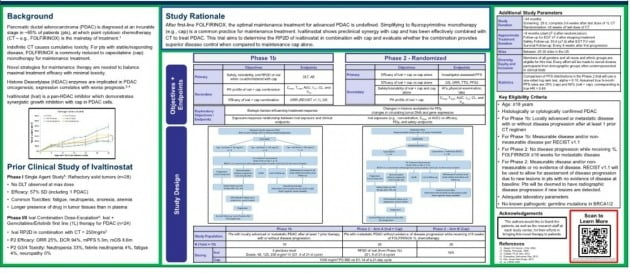
이번 임상은 진행성 또는 전이성 췌장암 환자 중 ‘폴피리녹스’ 요법 후 질병이 진행되지 않은 환자를 대상으로 한다. 이를 통해 아이발티노스타트의 1차 치료 반응 유지용법으로서의 가능성을 확인한다.
아이발티노스타트와 ‘카페시타빈’ 병용요법 및 카페시타빈 단독요법 간 안전성과 유효성을 비교 평가한다. 각각 26명의 환자를 무작위 배정해 무진행생존기간(PFS) 전체생존기간(OS) 객관적반응률(ORR) 등을 본다.
4제 병용의 폴피리녹스 요법은 현재 췌장암 환자들에게 1차 치료제로 가장 많이 처방된다. 그러나 이는 심각한 부작용을 유발해 치료를 오래 이어가기 힘들다는 설명이다. 이에 카페시타빈을 이어 처방한다.
또 치료 경험이 있거나 진행성 또는 전이성 췌장암 환자 중 질병이 진행되지 않는 18명 대상 용량증량시험 임상 1b상도 병행한다. 아이발티노스타트 투약 용량을 60mg에서 시작해 125mg, 250mg까지 증량해 약물 관련 3등급 이상의 이상반응과 내약성을 확인한다.
임상은 미국 내 최대 30개 병원에서 진행한다. 현재 17개 병원에서 임상시험윤리위원회(IRB)를 통과해 병원별 개시방문(SIV)이 이뤄지고 있다. 조만간 환자 모집이 시작될 것이란 예상이다.
크리스탈지노믹스 관계자는 “카페시타빈과 함께 내약성 및 안전성이 확인된 아이발티노스타트 병용투여 시 항암 효과가 유의미하게 증가할 것으로 기대한다”고 말했다.
이도희 기자 tuxi0123@hankyung.com




![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


