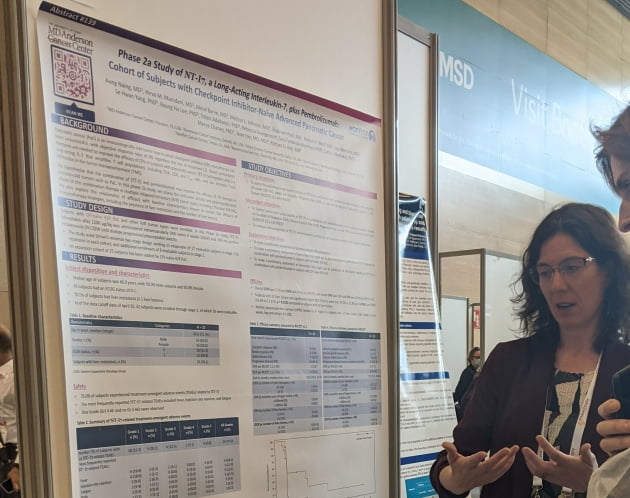
췌장암과 MSS 대장암은 기존 면역관문억제제 단독 요법에 반응하지 않는 난치암이다. 하지만 네오이뮨텍의 T세포 증폭제인 'NT-I7'과 키트루다 병용 요법에서 가능성을 보였다는 설명이다.
췌장암에서는 면역항암요법 반응평가기준인 'iRECIST' 기준 암의 크기가 기존 대비 30% 이상 줄어든 환자(iORR)가 7.7%, 반응지속기간(iDoR)은 7.2개월로 나타났다. 또 암 크기에 큰 변화 없이 진행이 통제되고 있는 환자(iDCR)는 34.6%였다. 이 중 간 전이가 한 곳 이하인 환자들의 질병통제율(iDCR)은 63.6%, 무진행생존기간 중앙값(mPFS)은 18주로 전체생존기간(OS)에 대한 기대가 커졌다고 했다.
면역항암요법은 암세포에 면역 작용이 나타나면서 일시적으로 종양 크기가 커지는 반응이 나타날 수 있다. 면역세포가 증가해 암세포가 커지는 것이다. 이를 고려한 평가법이 iRECIST다.
MSS 대장암의 경우, iRECIST 기준 객관적반응률은 11.1%였고, 반응지속기간은 6.7개월로 지난 6월 미국임상종양학회(ASCO)에서 발표했던 데이터 대비 약 2개월 증가했다. 질병통제율은 40.7%였다. 전이성 대장암의 85%를 차지하는 MSS 대장암은 아직 허가 받은 면역항암제가 없는 상황이다. MSD에서 키트루다 단독 요법으로 시도했으나 객관적반응률 0%, 질병통제율 11%에 불과했다.
MSS 대장암과 췌장암은 네오이뮨텍의 다양한 임상 중 신약 승인 가능성이 큰 적응증이라고 했다. 1b·2a상으로 안전성과 항암 효과를 확인한 만큼 MSD와 향후 계획을 논의하고, 연내 총 50명의 환자(MSS 대장암, 췌장암 각각 25명)를 추가 모집할 예정이다. 추가적인 안전성과 효능 데이터를 확보해 후속 임상 진입에 활용할 계획이다. 이 외에도 바이오마커(생체표지자) 분석 등도 진행 예정이다.
양세환 네오이뮨텍 대표는 "항암제 승인의 핵심은 결국 전체생존기간"이라며 "항암 효과를 지속시켜주는 NT-I7의 특성이 환자의 생존기간 연장에 기여할 것으로 기대하고 있다"고 말했다. 이어 "추가 환자에 대한 임상 결과가 준비되는대로 글로벌 학회에서 공개하고, 이를 통해 연말 혹은 내년 초 상업화 전략을 수립해 공개할 예정"이라고 했다.
한민수 기자 hms@hankyung.com