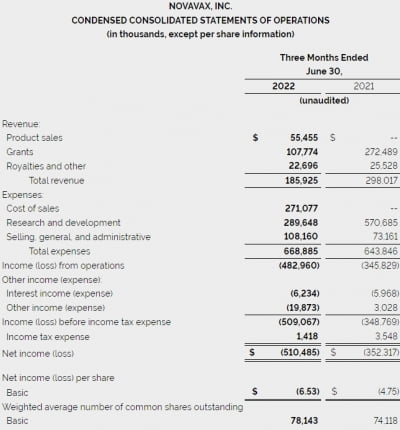
린파자는 ‘폴리 ADP-리보스 중합효소(PARP)’를 억제한다.
이번 승인으로 '인간표피성장인자수용체2(HER2)' 음성 고위험군 조기 유방암 환자 중 'BRCA 1·2 돌연변이(gBRCAm)'가 있으며, 선항암 치료(neoadjuvant chemotherapy) 혹은 보조항암화학요법을 받은 경험이 있는 성인에 대한 치료가 가능해졌다.
BRCA 돌연변이 및 HER2 음성 조기 유방암에 대한 유럽 최초의 승인 치료제다. 미국에서는 지난 3월에 승인됐다. 이전에는 BRCA 유전자 변이 및 HER2 음성인 전이성 유방암 치료제로 미국 일본 유럽 등에서 승인됐다.
유방암 환자의 약 90%는 조기 유방암 진단을 받는 것으로 알려졌다. BRCA 돌연변이는 유럽의 HER2 음성 환자의 약 10%에서 발견된다.
이번 승인은 지난해 6월 발표된 임상 3상 결과를 기반으로 이뤄졌다. 임상 3상에서 린파자 투여군은 위약(플라시보) 투여군 대비 침습성 무질환 생존기간(iDFS)이 통계적으로 유의하게 개선됐다. 침습성 유방암 재발이나 새로운 암 발병, 사망한 환자가 42% 적게 나타났다. 사망 위험은 플라시보군 대비 32% 감소했다.
이번 승인으로 아스트라제네카는 7500만달러(약 981억원)의 단계별 기술료(마일스톤)을 받게 된다. 올 3분기에 반영될 예정이다.
데이브 프레드릭슨 아스트라제네카 수석 부사장은 “이번 승인으로 린파자는 유럽에서 BRCA 돌연변이 HER2 음성 조기 유방암 환자에 사용할 수 있는 최초이자 유일한 의약품이 됐다”며 “생명을 위협하는 재발 위험을 줄이기 위해 린파자를 초기 치료에 활용할 수 있다”고 말했다.
엘리아브 바 MSD 최고의료책임자는 "보조치료제인 린파자는 질병 재발 및 사망 위험을 크게 줄일 수 있어 진단 후 빠르게 BRCA 검사를 실시하는 것이 중요하다“고 말했다.
박인혁 기자 hyuk@hankyung.com