암젠은 7일(미국 시간) 루마크라스와 면역관문억제제 ‘키트루다(미국 머크)’, ‘티센트릭(로슈)’를 비소세포폐암(NSCLC) 환자를 대상으로 병용 투여한 결과, 키트루다와의 병용에서 전체 생존기간(OS)과 반응기간(DOR)이 증가한 것을 확인했다고 발표했다.
하지만 중증 부작용으로 분류되는 3~4단계 간독성 부작용 비율이 크게 증가된 것으로 나타났다. 추후 임상에서는 부작용을 줄이기 위해 투약간격과 투약용량을 조절하는 게 변수가 될 것으로 보인다.
루마크라스와 면역관문억제제를 함께 투여한 병용임상인 ‘CodeBreaK’은 결과 발표 전부터 제약 및 바이오업계의 많은 주목을 받았다.
루마크라스는 비소세포폐암 환자 중 일부에게서 발견되는 KRAS G12C 돌연변이를 저해하는 약물 중 처음으로 지난해 5월 미국 식품의약국(FDA)의 승인을 받았다.
여기에 현재 비소세포폐암의 1차 요법으로 쓰이는 항 PD-1 면역관문억제제 키트루다와 항 PD-L1 면역관문억제제 티센트릭을 병용투여한 임상이 이번 세계폐암학회에서 중간 결과가 공개된 CodeBreaK 100과 CodeBreak 101이다.
비소세포폐암 환자들이 1차로 처방받는 블록버스터 항암제에 ‘따끈따끈한’ 신약을 병용한 임상 결과인 만큼 제약바이오 업계의 주목을 받는 건 당연한 일이었다.
단독투여시보다 간독성 문제 불거져
하지만 결과는 암젠과 업계의 기대치 양쪽에 미치지 못했다. 시험에 참여해 루마크라스와 PD-1/PD-L1 면역관문억제제를 동시에 투여받은 임상 환자 29명 중 중증 부작용에 해당하는 3~4등급의 간독성 비율이 약 50%로 나타났다.
루마크라스 단독 투여시 3~4등급 간독성 부작용 발생 비율은 12%였던 만큼 위험성이 4배 이상 증가한 것이다. 이 때문에 병용투여를 받은 환자 중 절반이 루마크라스나 면역관문억제제 둘 중 하나의 투약을 중단해야만 했다.
루마크라스와 면역관문억제제 사이의 투약 간격이 짧으면 짧을수록 부작용은 더 심각해졌다. 루마크라스를 투약한 뒤 21일 또는 42일 후 면역관문억제제를 투약한 환자군에 비해 동시에 두 약을 맞은 환자군에게서 간독성 부작용이 나타난 비율이 높았다. 특히 루마크라스의 시작 용량이 많을수록 간독성 부작용도 컸다.
위험이 커지면 효능이 커져야하는 데, 이에 대해서도 명쾌한 답을 하기 어렵다. 루마크라스 단독투여시 객관적반응률(ORR)은 36%가 넘는 반면, 이번 임상에서의 ORR은 29%에 그쳤다.
좀 더 들여다보면, 루마크라스와 면역관문억제제를 모두 투여받은 환자 58명 중 완전관해(CR)가 나온 환자는 2명(3.4%), 부분관해(PR)가 나온 환자는 15명(25.9%)이었다. 루마크라스 단독 투여 임상에서 보고된 CR과 PR의 비율은 각각 2%와 35%였다.
단독 투여시에 비해 병용 투여시 부분관해 비율이 크게 낮아졌다. CR 비율은 소폭 증가했지만 환자 수가 적어 단순 비교가 어렵다.
전체 생존기간, 희망될까
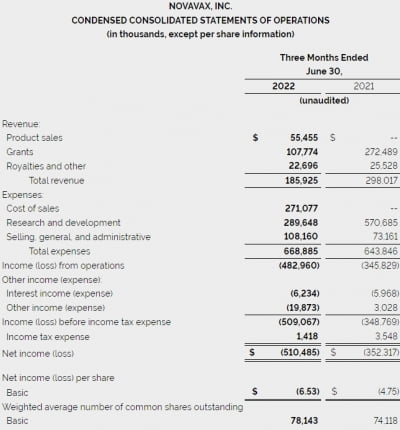
이번 결과에서 암젠이 주목한 부분은 전체 생존기간이다. 대부분 항암제 임상에 있어 전체 생존기간은 1차 평가변수인 만큼 의미있는 결과로 볼 수 있다.
루마크라스 단독 임상에서 OS는 12.5개월이었으나, 이번 병용 임상에선 어떤 면역관문억제제와 함께 투약했느냐에 따라 결과가 달라졌다. 21일 또는 42일 간격을 갖고 루마크라스와 티센트릭을 병용 투약했을 때 OS가 가장 짧았으며(8.1개월), 루마크라스와 키트루다를 동시병용했을 땐 14.1개월까지 늘어났다. 요약하자면, 키트루다와 병용했을 때 효과가 더 좋았다.
암젠은 키트루다와 티센트릭 중 좀 더 나은 OS를 보인 키트루다와의 병용요법 임상을 더 진행하겠다는 계획이다. 암젠 관계자는 “루마크라스를 먼저 투약한 뒤 키트루다를 투약한 환자군에서 17.9개월이라는 기존 대비 크게 증가한 반응기간(DOR) 중앙값을 얻었다”며 “루마크라스의 투약용량을 줄여 부작용 문제를 완화하는 식으로 연구를 계속 진행할 것”이라고 밝혔다.
반응기간이란 완전관해(CR) 또는 부분관해(PR)가 관찰된 시점에서 종양이 다시 진행이 관찰되는 시점(재발)까지의 기간이다. 루마크라스 단독 임상에서 보고된 DOR 중앙값은 10개월이었다.
이우상 기자 idol@hankyung.com