SK바이오팜 ‘수노시’, 액섬 인수 후 美매출 115억원 기록
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
액섬, 4분기 수노시 ADHD 2·3상 시작
액섬은 수노시의 글로벌 판권을 보유하게 된 세 번째 회사다. SK바이오팜은 2011년 아시아 12개국을 제외한 수노시의 글로벌 판권을 미국 에어리얼바이오파마에 기술수출했다. 3년 뒤 에어리얼은 재즈 파마슈티컬스에 이 권리를 넘겼다. 지난 3월 재즈는 다시 액섬에 수노시의 글로벌 권리를 이전했다.
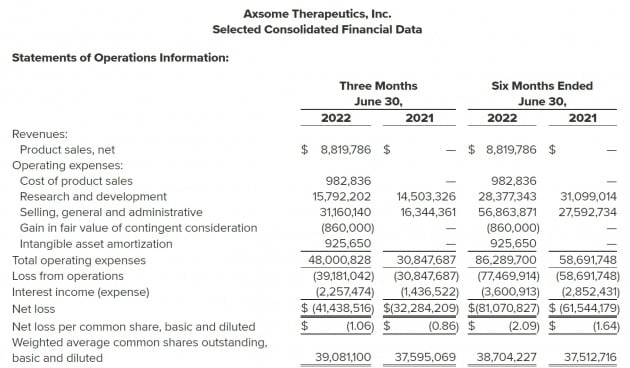
액섬은 지난 5월9일자로 재즈 파마슈티컬스가 보유하던 수노시의 미국 권리 인수 작업을 우선적으로 마쳤다. 이번에 공개한 수노시 미국 매출 880만달러는 이날부터 6월30일까지 집계된 수치다.
수노시는 SK바이오팜이 개발한 수면장애 치료제다. 기면증 또는 폐쇄성 수면 무호흡증(OSA)으로 인한 과도한 졸림(EDS)에 처방된다. EDS를 막기 위해 방출되는 ‘도파민’과 ‘노르에피네프린’이 세포 내로 재흡수되는 것을 억제하는 기전을 가지고 있다. 이들이 세포 밖에 있어야 EDS를 막는 역할을 하기 때문이다.
2019년 미국 식품의약국(FDA), 2020년 유럽 의약품청(EMA)에서 품목허가를 받았다. 지난해부터는 캐나다에서도 시판이 가능해졌다.
액섬은 수노시의 적응증에 주의력결핍 과다행동장애(ADHD)를 추가해 새롭게 임상에 착수한다는 계획도 세웠다. 회사는 지난 6월 전문가(KOL)들과 함께 가상(버추얼) 행사를 열고 이 같이 발표했다.
ADHD는 어린이와 성인에서 흔히 나타나는 장애다. 유전 및 환경적으로 다양한 발병 요인이 있지만 주로 도파민과 노르에피네프린과 관련이 있다는 게 액섬의 설명이다. 수노시를 ADHD 치료제로 개발하게 된 배경이다. 현재 미국에 청소년 430만7000명, 성인 723만2400명의 ADHD 환자가 있는 것으로 액섬은 추정하고 있다.
액섬 측은 “수노시의 기전인 도파민 및 노르에피네프린 재흡수 억제는 ADHD의 병태생리와 관련이 있다”며 “수노시는 반감기가 7.1시간으로 길고 남용 가능성이 낮은 비자극성 약물인데다, 이전 임상에서 충분한 안전성 및 내약성을 확인해 적응증을 ADHD로 확대하게 됐다”고 설명했다.
회사는 이번 2분기 실적발표에서 올 4분기 수노시의 ADHD 임상 2·3상을 시작한다는 계획을 한 번 더 밝혔다. 임상은 무작위 이중맹검 위약대조 방식으로 진행한다. 18세 이상 55세 이하 총 200명의 환자를 투약군과 위약군에 각각 100명씩 배정하고 4주간 매일 수노시 150mg 또는 위약을 처방한다. 1차 평가지표는 4주차의 ‘ADHD 연구자증상평가척도(AISRS)’다. 주요결과(톱라인)는 내년 하반기에 확보할 수 있을 것으로 보고 있다.
액섬은 수노시의 미국 EDS 치료제 잠재 매출을 연간 약 3억~5억달러(약 3900억~6400억원)로 보고 있다. 여기에 향후 개발될 신규 적응증을 포함하면 연 10억달러(약 1조3000억원)까지 가능할 것이란 예상이다.
이도희 기자 tuxi0123@hankyung.com


![SK바이오팜, 2분기 영업손실 401억…적자 축소[주목 e공시]](https://img.hankyung.com/photo/202208/01.30736305.3.jpg)