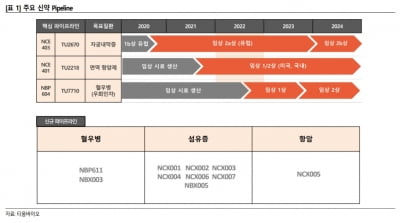
회사는 앞서 2a상 1단계 ‘공개 시험(오픈 라벨)’ 평가에서 OLP-1002를 1㎍(마이크로그램) 투여 시 1차 요법 치료제 특성에 부합하는 강한 진통 효능 및 긴 약효 지속력을 관찰했다. 1㎍은 말초 신경 제어에 특화된 임상 용량이다.
이번에 승인 받은 2단계 평가에서는 관절염 환자들에게 1~2㎍의 OLP-1002 또는 위약을 투여한 뒤 6주간 진통 효능을 위약대조 및 이중맹검 방식으로 확인한다. 투여는 9월부터 시작된다.
OLP-1002는 올리패스의 인공유전자 플랫폼 기술로 개발됐다. 이 플랫폼 기술은 ‘전구체 메신저리보핵산(Pre-mRNA)’ 표적(타기팅)에 특화돼있다.
회사 측은 “Pre-mRNA 타기팅으로 전체 질병의 50% 이상을 치료할 수 있다”며 “그러나 감염성 질환 및 돌연변이에 의한 암 등 일부 난치성 질환은 mRNA 타기팅 없이 치료제 개발이 어렵다”고 했다. 이에 회사의 인공유전자 플랫폼 적용 범위를 mRNA까지 확장시키기 위해 ‘올리패스 리보핵산(RNA) 가위’ 기술을 개발하고 있다는 설명이다.
올리패스의 ‘PNA’ 인공유전자에 RNA 가위 기능을 접목하면 짧은간섭리보핵산(siRNA)처럼 타깃 mRNA를 분해할 수 있을 것이란 게 회사의 예상이다.
정신 올리패스 대표는 “올리패스의 RNA 가위는 siRNA가 보유한 mRNA 분해 기능에 우수한 세포투과성이 부가된 인공유전자 플랫폼 기술”이라며 “이 RNA 가위 기술이 회사의 플랫폼 타깃을 Pre-mRNA에서 mRNA으로 확장시켜 줄 것”이라고 말했다.
이도희 기자 tuxi0123@hankyung.com



![[단독] "손 꼭 잡고 다니던 부부"…알고보니 100억 사기꾼](https://img.hankyung.com/photo/202502/01.39490611.3.jpg)


