美 테나야 테라퓨틱스, 'HDAC6' 억제제 FDA 1상 승인
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
박출률보존 심부전 치료제 후보
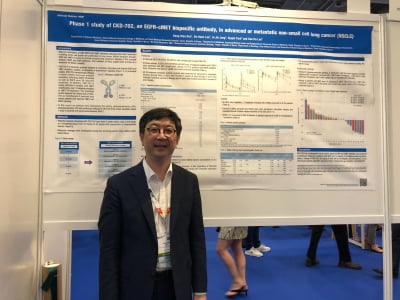
종근당, HDAC6 억제제 개발 중
종근당, HDAC6 억제제 개발 중
미국 테나야 테라퓨틱스는 미국 식품의약국(FDA)이 ‘히스톤탈아세틸화효소6(HDAC6)’ 억제제인 ‘TN-301’의 임상 1상을 승인했다고 6일(현지시간) 밝혔다.
TN-301은 박출률보존 심부전(HFpEF) 치료제로 개발 중인 먹는(경구용) 저분자화합물이다.
테나야는 건강한 성인을 대상으로 1상을 진행할 계획이다. 무작위 이중맹검 위약대조를 통해 TN-301의 안전성과 내약성, 약동학 및 약력학을 평가한다.
임상 1상 1단계는 단일상승용량(SAD), 2단계는 다중상승용량(MAD)으로 진행된다.
HFpEF는 전신 염증, 좌심실 비대, 섬유증, 이완기 기능 장애 등을 동반하는 심장 질환이다. 테나야에 따르면 모든 심부전의 절반 가량을 차지하지만 효과적인 치료법은 없다.
테나야는 TN-301의 전임상을 통해 염증 감소, 대사기능 장애 정상화, 확장기 기능장애 개선 등의 결과를 확인했다.
위트 팅글리 테나야 수석의학박사는 “TN-301의 전임상에서 HFpEF의 특징인 좌심실 이완 및 충만을 개선할 수 있는 가능성을 확인했다”며 “이번 FDA의 승인은 내부에서 발굴한 후보물질을 처음 임상 단계로 전환한 중요한 이정표”라고 말했다.
국내에서는 종근당이 HDAC6 억제제 플랫폼 기술을 기반으로 헌팅턴병 치료제 ‘CKD-504’ CMT 치료제 ‘CKD-510’, 자가면역질환 치료제 ‘CKD-506’을 각각 개발 중이다. CKD-504는 국내와 미국에서 임상 1상을 진행 중이다. CKD-506은 유럽 2상을 진행하고 있다.
CKD-510은 지난 5월 국제말초신경학회(PNS)에서 유럽 1상 및 전임상 연구 결과를 발표했다. 건강한 성인 87명을 대상으로 진행한 임상에서 약물의 안전성과 내약성을 입증했다. 현재 임상 2상 진입을 준비 중이다.
전임상 연구를 통해 CKD-510을 심장질환 치료제로 개발할 가능성도 확인했다. 지난달 스페인바르셀로나에서 열린 유럽심장학회 연례학술대회에서 심방세동 동물모델 실험 결과를 발표했다. CKD-510은 심방세동 환자에서 일어나는 미세소관 붕괴를 억제해 칼슘이온(Ca2+)의 이동을 정상화하고 심방세동 부담을 감소시켰다. 좌심실 기능도 향상시켰다.
심방세동은 심방의 규칙적인 수축이 소실돼 불규칙하게 맥박을 일으키는 질환이다. 기존 치료제로 이온채널 차단제가 있지만 효과가 충분하지 않다. 또 동서맥 심실부정맥 등 안전성 우려로 미충족 수요가 있다고 했다.
박인혁 기자 hyuk@hankyung.com
TN-301은 박출률보존 심부전(HFpEF) 치료제로 개발 중인 먹는(경구용) 저분자화합물이다.
테나야는 건강한 성인을 대상으로 1상을 진행할 계획이다. 무작위 이중맹검 위약대조를 통해 TN-301의 안전성과 내약성, 약동학 및 약력학을 평가한다.
임상 1상 1단계는 단일상승용량(SAD), 2단계는 다중상승용량(MAD)으로 진행된다.
HFpEF는 전신 염증, 좌심실 비대, 섬유증, 이완기 기능 장애 등을 동반하는 심장 질환이다. 테나야에 따르면 모든 심부전의 절반 가량을 차지하지만 효과적인 치료법은 없다.
테나야는 TN-301의 전임상을 통해 염증 감소, 대사기능 장애 정상화, 확장기 기능장애 개선 등의 결과를 확인했다.
위트 팅글리 테나야 수석의학박사는 “TN-301의 전임상에서 HFpEF의 특징인 좌심실 이완 및 충만을 개선할 수 있는 가능성을 확인했다”며 “이번 FDA의 승인은 내부에서 발굴한 후보물질을 처음 임상 단계로 전환한 중요한 이정표”라고 말했다.
종근당, HDAC6 억제제로 심방세동치료제 개발 가능성 확인
HDAC6은 인체 내의 효소다. 과발현되면 세포질 내 물질 수송에 관여하는 미세소관(마이크로튜블)의 안정성 및 세포의 기능을 떨어뜨린다. 이는 심장질환, 알츠하이머성 치매, 헌팅턴병 및 샤르코마리투스병(CMT) 등의 발현과 관계가 있는 것으로 알려졌다.국내에서는 종근당이 HDAC6 억제제 플랫폼 기술을 기반으로 헌팅턴병 치료제 ‘CKD-504’ CMT 치료제 ‘CKD-510’, 자가면역질환 치료제 ‘CKD-506’을 각각 개발 중이다. CKD-504는 국내와 미국에서 임상 1상을 진행 중이다. CKD-506은 유럽 2상을 진행하고 있다.
CKD-510은 지난 5월 국제말초신경학회(PNS)에서 유럽 1상 및 전임상 연구 결과를 발표했다. 건강한 성인 87명을 대상으로 진행한 임상에서 약물의 안전성과 내약성을 입증했다. 현재 임상 2상 진입을 준비 중이다.
전임상 연구를 통해 CKD-510을 심장질환 치료제로 개발할 가능성도 확인했다. 지난달 스페인바르셀로나에서 열린 유럽심장학회 연례학술대회에서 심방세동 동물모델 실험 결과를 발표했다. CKD-510은 심방세동 환자에서 일어나는 미세소관 붕괴를 억제해 칼슘이온(Ca2+)의 이동을 정상화하고 심방세동 부담을 감소시켰다. 좌심실 기능도 향상시켰다.
심방세동은 심방의 규칙적인 수축이 소실돼 불규칙하게 맥박을 일으키는 질환이다. 기존 치료제로 이온채널 차단제가 있지만 효과가 충분하지 않다. 또 동서맥 심실부정맥 등 안전성 우려로 미충족 수요가 있다고 했다.
박인혁 기자 hyuk@hankyung.com


![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


