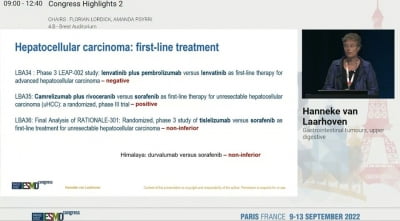
mOS 9.3개월로 폴폭스 단독 대비 우수

이번 콘퍼런스는 오는 16일(현지시간)까지 미국 보스턴에서 열린다. 메드팩토는 췌장암 대상 백토서팁·폴폭스(FOLFOX) 병용요법에 대한 임상 1b상 중간결과를 공개했다.
췌장암 2차 치료에 대한 이번 임상에서 백토서팁 200mg를 1일 2회 투여한 13명 환자의 전체생존기간 중간값(mOS)는 9.3개월이었다. 객관적반응률(ORR)은 23.1%였고, 38.5%는 암이 더 커지지 않는 안전병변(SD)으로 확인됐다. 이에 따른 임상적 유용성(Clinical benefit)은 61.5%다. 무진행생존기간 중간값(mPFS)은 4.2개월이었다.
기존 젬시타빈 치료 실패 환자 대상 폴폭스 2차 요법(FIRGEM Study)에서의 mOS는 4.3개월이었다는 설명이다. mPFS는 1.7개월, ORR은 0%를 기록했다. 또다른 폴폭스 단독요법 임상(SEQUOIA Study)에서도 mOS 6.3개월, mPFS 2.1개월, ORR 5.6%가 나왔다.
췌장암은 조밀한 세포외기질이 암을 둘러싸고 있어 항암 치료가 어려운 난치병이다.
메드팩토 관계자는 "이번 임상 데이터는 췌장암 환자에서 백토서팁과 폴폭스 병용요법이 기존 치료법 대비 월등한 치료 효과가 있음을 확인한 것"이라고 말했다.
메드팩토는 백토서팁과 폴폭스 병용요법 외에도 췌장암 대상 백토서팁과 '5FU/LV/오니바이드' 병용요법에 대한 연구자 임상 1b상도 진행 중이다. 지난해 4월 AACR에서 발표한 백토서팁과 5FU/LV/오니바이드 병용요법 전임상 결과에 따르면 암 세포의 전이가 현저하게 감소한 것을 확인했다. 백토서팁과 5FU/LV/오니바이드 병용요법은 작년 미국 식품의약국(FDA)로부터 희귀의약품 지정(ODD)을 받았다.
회사는 연내 백토서팁과 5FU/LV/오니바이드 병용요법의 허가목적 임상 1·2상을 FDA에 신청할 예정이다. 내년 1월 개최되는 미국 임상종양학회 위장관종양 심포지엄(GI ASCO)에서 백토서팁과 오니바이드 병용요법에 대한 1b상 중간결과를 공개할 계획이다.
한민수 기자 hms@hankyung.com