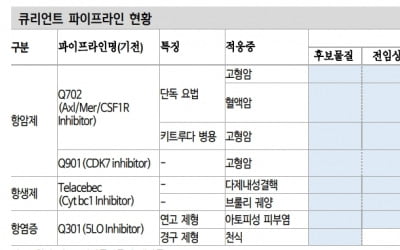
대상 환자는 20명이다. 임상 1상에는 참여했으나 임상 2상에 포함되지 못한 환자들이다.
임상시험용 의약품 치료목적 사용승인은 허가 전의 약을 중증질환을 앓는 환자나 대체치료 수단이 없는 환자에 한해 사용하도록 허가하는 제도다. 퓨쳐켐은 이번 승인을 통해 치료받는 환자를 대상으로 FC705 투여 전 진단 및 투여 후 평가를 진행할 예정이다.
FC705는 호르몬 치료와 항암치료가 듣지 않는 전이성 거세저항성 전립선암 치료제다. 퓨쳐켐은 현재 FC705의 미국 임상 1·2a상과 국내 임상 2상을 진행 중이다. 글로벌 제약사 및 방사성의약품 회사들과 협업 및 기술이전도 논의 중이란 설명이다.
이도희 기자 tuxi0123@hankyung.com